Voorwoord
Het Dutch Institute for Clinical Auditing (DICA) faciliteert klinische uitkomst van zorgregistraties. Gegevens worden continue verzameld en teruggekoppeld. Gecombineerd met een online benchmark weten zorgverleners ‘realtime’ hoe het met de kwaliteit van zorg in hun instelling is gesteld. Hierdoor is het mogelijk om direct verbeteringen door te voeren oponderdelen waar de kwaliteit achterblijft. Door op deze wijze inzicht te geven, zijn door het DICA-systeem al veel verbeteringen en besparingen gerealiseerd. Daarnaast zijn patiëntenverenigingen, beroepsorganisaties van medisch specialisten, zorgverzekeraars, ziekenhuizen en andere stakeholders in staat om op basis van betrouwbare DICA-gegevens, afspraken met elkaar te maken over kwaliteitsindicatoren en geleverde en nog in te kopen zorg. Omdat er volgens een vast format wordt gewerkt, komt de doorontwikkeling van het systeem direct aan alle deelregistraties ten goede.
Huidige ontwikkelingen
Afgelopen jaar stond voor DICA in het teken van uitbreiding. Op dit moment zijn de audits van darm-, borst-, maag- en slokdarmkanker, longchirurgie, aneurysmachirurgie, pancreaschirurgie, kinderchirurgie en radiotherapie onderdeel van DICA. De komende tijd volgt verdere uitbreiding naar andere:
- behandelingen van goedaardige aandoeningen;
- behandelingen buiten het chirurgische domein;
- multidisciplinaire zorg en
- ketenzorg.
Aan het einde van 2013 telt DICA ongeveer vijftien registraties.
Er wordt daarnaast hard gewekt aan koppelingen met de belangrijke dataregisters en elektronische patiëntendossiers. Samen met een optimalisatie van de workflow binnen bestaande systemen, zal door deze ontwikkelingen de registratielast steeds verder afnemen. Verder doet DICA met de Dutch Melanoma Treatment Registry (DMTR) nu ook ervaring op met een registratie die dient als platform voor doelmatigheidsonderzoek voor recent beschikbaar gekomen medicatie en therapieën. Hierbij wordt samengewerkt met de Nederlandse Vereniging voor Medische Oncologie (NVMO), Win-O, patiëntenvereniging (Stichting Melanoom), betrokken farmaceuten, College van Zorgverzekeringen, ZonMw, instituut Beleid en Management Gezondheidszorg te Rotterdam en het Integraal Kankercentrum Nederland (IKNL).
Samenwerking
Voor de oncologische aandoeningen werkt DICA nauw samen met de Nederlandse Federatie van Kankerpatiëntenverenigingen (NFK). Samen met NFK voert DICA een project uit voor de uitvraag van patiëntervaringen bij de behandeling van darmkanker (PROM’s, “showcase darmkanker”).
Samenwerking DICA en IKNL
De Nederlandse Kankerregistratie (NKR), uitgevoerd door het Integraal Kankercentrum Nederland (IKNL) en het Integraal Kankercentrum Zuid (IKZ) is internationaal gezien een unieke epidemiologische registratie. DICA en IKNL werken daarom, voor wat betreft de oncologische registraties, samen en streven op dit domein naar een gecombineerd systeem dat voor verschillende doelen gebruikt kan worden: epidemiologie, snelle terugkoppeling voor kwaliteitsverbetering, externe kwaliteitscontroles en doelmatigheidsonderzoek bij de introductie van nieuwe geneesmiddelen.
IKNL introduceert in 2013 een nieuw softwaresysteem voor de kankerregistratie, hierbij wordt gebruik gemaakt van dezelfde software die binnen DICA wordt toegepast. Hierdoor kunnen gezamenlijk gegevens verzameld, uitgewisseld en teruggekoppeld worden aan de behandelaars, inclusief lange termijn gegevens. Behandelaars en de NKR-medewerkers kunnen hun gegevens dan in hetzelfde systeem (voor elkaar) invoeren en kijken op het scherm bij elkaar mee wat er wordt geregistreerd. Specialisten kunnen door NKR-medewerkers ingevoerde gegevens vervolgens corrigeren en in het registratiesysteem accorderen. Medewerkers van de NKR kunnen op hun beurt de gegevens valideren die door de behandelaars zelf zijn ingevoerd. In december 2012 is een pilot voor deze samenwerking gestart voor patiënten met borstkanker. Gegevens voor de NABON Breast Cancer Audit (NBCA) worden verzameld in een gecombineerd registratiesysteem.
In deze rapportage
Naast de rapportage van de registraties over het jaar 2012, treft u in deze jaarrapportage informatie aan over DICA en komen anderen aan het woord. Dit jaar zijn de samenvattingen van de resultaten als publicatie verschenen. De uitgebreide rapportage vindt u dit jaar online: www.clinicalaudit.jaarrapportage.nl
De toekomst
De grootste uitdaging voor de komende tijd is de beheersbaarheid van de zorg. DICA is van mening dat alleen de koppeling tussen uitkomst van zorgregistraties met de uitvraag van patiëntervaringen en financiële gegevens deze noodzakelijke sturing daadwerkelijk mogelijk maakt. Pas wanneer we deze drie componenten met elkaar weten te verbinden zijn we in staat om goede en betaalbare zorg te leveren waar patiënten tevreden over zijn. Daarbij is het essentieel om te investeren in bestaande systemen die hun nut de afgelopen jaren hebben bewezen en die in staat zijn om deze verbinding tot stand te brengen.
Michel Wouters, hoofd wetenschappelijk bureau DICA, eindredacteur
Eric-Hans Eddes, directeur DICA
Rob Tollenaar, voorzitter DICA

Samenvatting DSCA
In navolging van het Zweedse systeem van kwaliteitsregistraties is in 2009 de DSCA opgestart met als primair doel het verbeteren van de kwaliteit van de darmkankerzorg in Nederland. De DSCA is hierbij een blauwdruk voor Nederlandse uitkomstregistraties waarin, door continue feedback van uitkomstgegevens gespiegeld aan het landelijk gemiddelde (benchmarking), de behandelaars gestimuleerd worden tot continue verbetering van de zorg.
Validatie
Voor een betrouwbare vergelijking van uitkomsten van zorg tussen ziekenhuizen is het van groot belang dat de geregistreerde gegevens volledig en correct geregistreerd zijn. Alleen met complete en correcte gegevens kunnen uitkomsten adequaat gecorrigeerd worden voor zorgzwaarteverschillen tussen ziekenhuizen (casemix-correcties). Door eenduidige definities, foutenrapportages en vergelijkingen met externe databases zoals die van de Nederlandse Kankerregistratie (NKR) controleert de DSCA de juistheid van de verzamelde kwaliteitsinformatie.
In 2012 registreerden alle ziekenhuizen in de DSCA en is naar schatting 97% van de daarvoor in aanmerking komende patiënten geïncludeerd in de kwaliteitsregistratie. Deelname aan de DSCA is een kwaliteitsnorm van de Nederlandse Vereniging voor Heelkunde (NVvH) en ook van de Samenwerkende Oncologische Specialismen (SONCOS). Daarnaast is het een prestatie-indicator van IGZ.
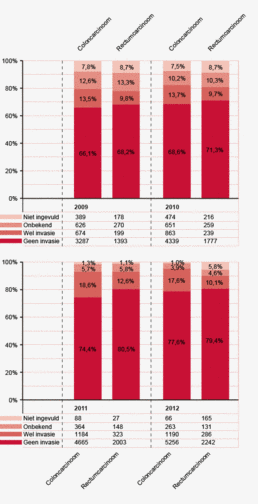
Ter validatie zijn dit jaar de DSCA-gegevens over het registratiejaar 2011 vergeleken met die van de NKR. Van de volgens de NKR daarvoor in aanmerking komende patiënten is 94% dat jaar geregistreerd in de DSCA. De database blijkt in de loop der jaren steeds vollediger te worden, waarschijnlijk doordat ‘missing items’ structureel worden teruggekoppeld aan de ziekenhuizen en doordat deze hun registratiemethodiek steeds beter op orde krijgen.
Op landelijk niveau zijn patiënt-, tumor- en behandelkarakteristieken vergeleken tussen de NKR en de DSCA en deze komen op vele punten overeen. Er is een blijvend verschil in het percentage patiënten met darmnaadlekkage. Het begrip naadlekkage is gevoelig voor definitieverschillen en kan daardoor anders geregistreerd worden door clinici dan door de datamedewerkers van de NKR. De gerapporteerde 30-dagenmortaliteit is in de DSCA lager dan in de NKR.
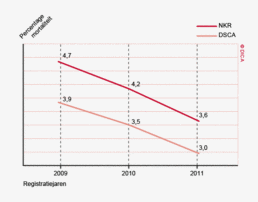
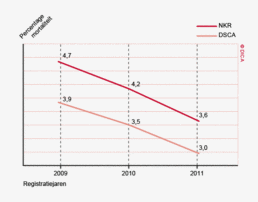
In beide registraties is sinds de start van de DSCA een duidelijk dalende trend te zien in de 30-dagenmortaliteit (zie figuur 1). In de NKR daalde de mortaliteit voor patiënten met een coloncarcinoom van 5,5% (2009) naar 4,1% (2011), in de DSCA van 4,5% naar 3,4%. Voor patiënten met een rectumcarcinoom daalde de mortaliteit in de NKR van 2,6% naar 2,3%, in de DSCA van 2,4% naar 2,2%.
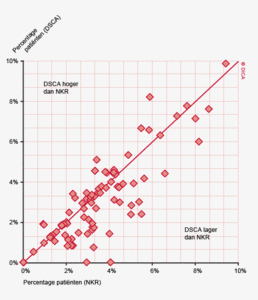
Dit jaar zijn voor het eerst de gegevens van de DSCA en NKR op ziekenhuisniveau vergeleken voor verschillende indicatoren. Soms lijkt er sprake van onder- en soms van overrapportage, zoals te zien is in figuur 2. Zonder een controle op patiëntniveau zijn deze verschillen (nog) niet te duiden. Verschillen in inclusie van de patiënten door de DSCA en NKR kunnen bijvoorbeeld aan deze discrepanties ten grondslag liggen. In 2013 zal door de DICA dataverificatie op patiëntniveau uitgevoerd worden in de deelnemende ziekenhuizen.
Verschillen zullen eveneens afnemen wanneer protocollaire verslaglegging in alle ziekenhuizen geïmplementeerd wordt. Een voorbeeld van protocollaire verslaglegging zijn de pro-forma verslagen van de pathologen, maar bij voorkeur zouden ook radiologie- en operatieverslagen eenduidig gestructureerd worden. Ook het terugkoppelen van de gevonden discrepanties aan de ziekenhuizen en NKR-medewerkers kan een corrigerend effect hebben.
Resultaten
In 2012 zijn er opnieuw meer patiënten met een colorectaal carcinoom in de DSCA geregistreerd dan het jaar er voor, namelijk 10.014 patiënten. Dit zijn 9.946 analyseerbare patiënten, 6.750 patiënten met een coloncarcinoom, 2.806 patiënten met een rectumcarcinoom en 390 patiënten met een dubbeltumor.
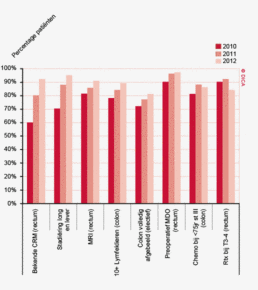
Ook in het vierde jaar van de registratie worden er nog steeds verbeteringen gezien in de indicatorresultaten voor de kwaliteit van het gehele zorgtraject. Zo wordt de richtlijn voor wat betreft het preoperatieve traject steeds beter gevolgd en wordt vrijwel elke patiënt met een rectumcarcinoom besproken in een multidisciplinair overleg voorafgaand aan de operatie.
De wachttijden zijn de afgelopen jaren enigszins verbeterd. Van de patiënten met een coloncarcinoom wordt 88% binnen 7 weken (Treeknorm) behandeld (86% in 2009) en van de patiënten met een rectumcarcinoom wordt bij 79% binnen 7 weken gestart met de behandeling (73% in 2009). Hierin wordt een flinke spreiding gezien tussen ziekenhuizen in Nederland. Dit kan samenhangen met de logistiek in een ziekenhuis en de complexiteit van de patiëntenpopulatie.
Opvallend is ook de blijvende toename in laparoscopische colorectale chirurgie. In electieve setting wordt deze minimaal invasieve benadering nu bij de helft van alle resecties toegepast. Dit aandeel van laparoscopische chirurgie ligt internationaal gezien zeer hoog.
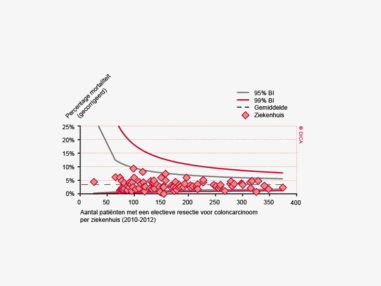
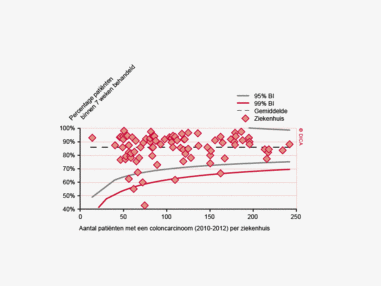
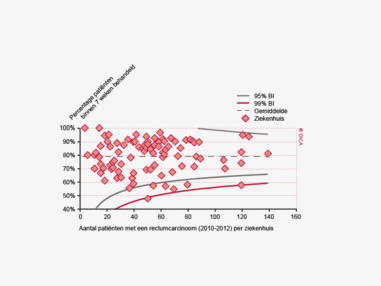
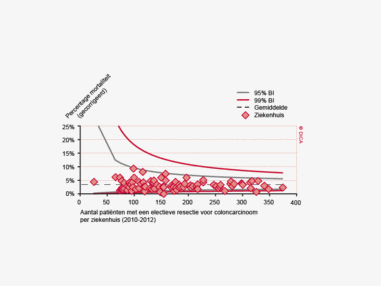
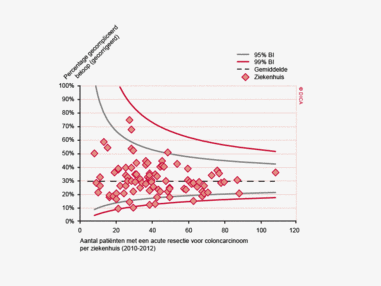
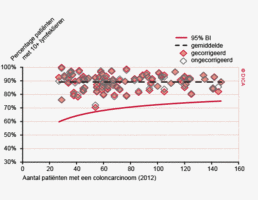
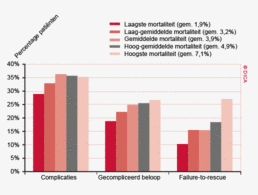
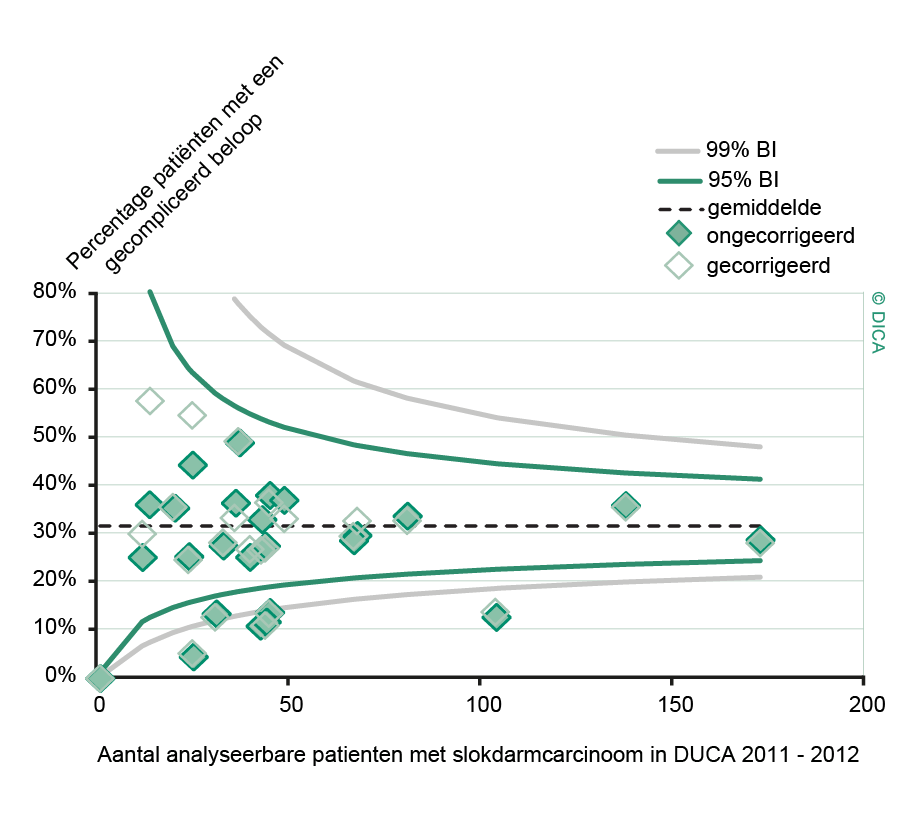
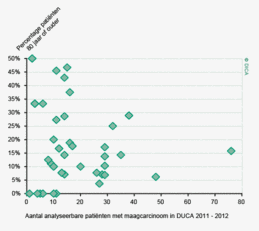
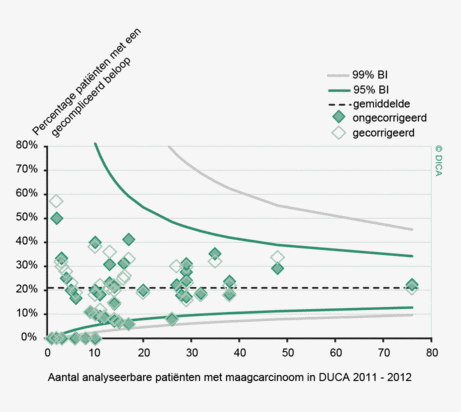
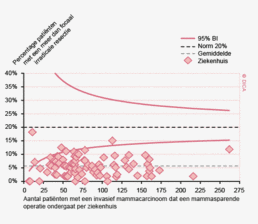
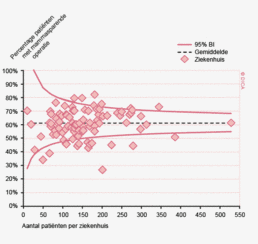
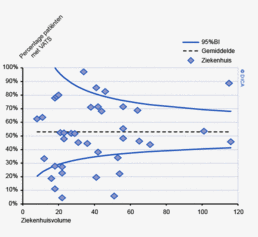
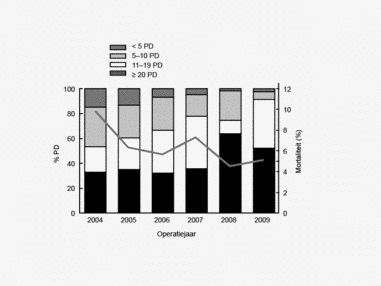
Een aantal belangrijke uitkomstparameters zijn wederom verbeterd. Het percentage irradicale tumorresecties neemt fors af ten opzichte van 2009 (colon: 4,6% naar 3%, rectum: 14% naar 8%). Ook postoperatieve complicaties en mortaliteit komen steeds minder voor. In figuur 3 wordt in een funnelplot het percentage postoperatieve mortaliteit per ziekenhuis getoond na een colonresectie in electieve setting. De mortaliteit onder de patiënten met een coloncarcinoom daalde van 4,5% naar 3,2%, onder de patiënten met een rectumcarcinoom van 2,4% naar 1,5%, een relatieve risicoreductie van respectievelijk 30% en 40%.
Ook is de mediane opnameduur afgenomen, wat een aanzienlijke besparing voor de zorgkosten zal betekenen. In 2012 liggen patiënten met een coloncarcinoom mediaan 7 dagen in het ziekenhuis (8 dagen in 2009) en patiënten met een rectumcarcinoom mediaan 8 dagen (10 dagen in 2009).
Richtlijnnaleving
Sinds de start van de DSCA is de richtlijnnaleving op veel onderdelen sterk verbeterd, waarbij ook de variatie tussen ziekenhuizen sterk is afgenomen. De richtlijn wordt in hoog- en laagvolume ziekenhuizen net zo goed gevolgd.
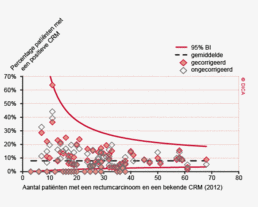
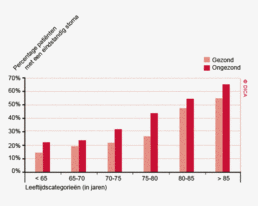
Een toenemend percentage patiënten met een rectumcarcinoom wordt geopereerd in een ziekenhuis dat aan de recent geïntroduceerde landelijke volumenorm van 20 of meer rectumresecties per jaar voldoet (89% in 2012 tegenover 80% in 2010). Er zijn aanwijzingen dat deze centralisatie zal leiden tot betere uitkomsten. In de DSCA lijkt een rectumresectie in een hoogvolume ziekenhuis geassocieerd met een lager percentage positieve circumferentiële resectie marges (CRMs): 7,4% tegenover 13% in laagvolume ziekenhuizen.
Pathologie
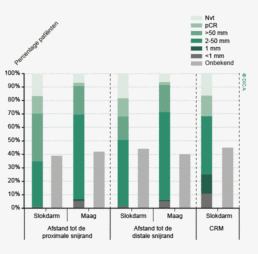
De uitkomst van het pathologisch onderzoek bepaalt voor een belangrijk deel de prognose en het verdere behandelbeleid voor de patiënt. Een nauwkeurige beoordeling van het weefsel dat bij de patiënt verwijderd is, staat daarbij voorop. Het percentage patiënten waarbij 10 of meer lymfeklieren wordt onderzocht is de afgelopen jaren gestegen met een afname in ziekenhuisvariatie. Daarnaast is in 3 jaar tijd de verslaglegging van de CRM met 40% toegenomen. De terugkoppelingen van de DSCA kunnen een substantiële bijdrage hebben geleverd aan deze kwaliteitsverbeteringen.
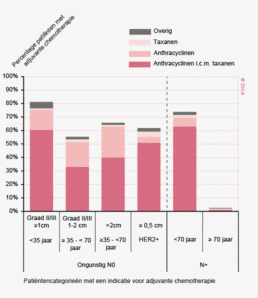
De focus op de compleetheid van de pathologische verslaggeving zal de komende tijd verlegd worden naar de items ‘extramurale veneuze invasie’ bij colorectale tumoren en ‘radicaliteit van het distale resectievlak’ bij rectumtumoren. De extramurale veneuze invasie is namelijk van invloed op de keuze voor adjuvante chemotherapie bij patiënten zonder lymfekliermetastasen.
Failure to rescue
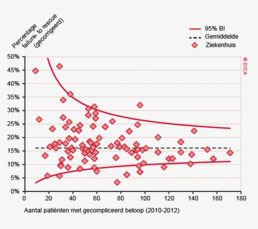
Hoewel er een forse verbeterslag is gemaakt sinds de start van de DSCA, gaat de colorectale oncologische chirurgie nog altijd gepaard met aanzienlijke postoperatieve morbiditeit en mortaliteit. De DSCA zoekt voortdurend naar aangrijpingspunten voor verdere verbetering. Dit betreft niet alleen het voorkomen van complicaties, maar ook het beperken van de gevolgen ervan. Uit de wetenschappelijke literatuur is gebleken dat ziekenhuizen soms weinig verschillen in het percentage patiënten met complicaties na een operatie, maar dat de sterfte ten gevolge van die complicaties wel aanzienlijk verschilt. Het vroeg ontdekken en adequaat behandelen van complicaties kan orgaandysfunctie, secundaire complicaties en overlijden voorkomen. Ook in de DSCA zijn er ziekenhuizen waar patiënten met een gecompliceerd beloop een hogere kans lijken te hebben om aan de complicaties te overlijden (failure to rescue; FTR). Door terugkoppeling van FTR-gegevens zouden behandelteams het opsporen en behandelen van complicaties beter in kaart kunnen brengen en zo gericht de postoperatieve sterfte verder terug kunnen dringen. Het inventariseren van ‘best practices’ in de protocollaire monitoring van postoperatieve patiënten, de beschikbaarheid van Spoed Interventie Teams en de organisatie van (avond-weekend)diensten zou hierbij kunnen helpen.
Leeftijd en comorbiditeit
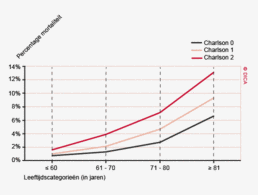
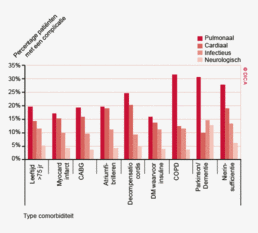
De gewenste alertheid voor het tijdig onderkennen van een complicatie kan worden bereikt met een goede preoperatieve risico-inventarisatie. Het colorectaal carcinoom komt vooral voor op oudere leeftijd. In de groep ouderen is de risico-inschatting juist moeilijk te maken door de relatieve onderrapportage van resultaten van behandeling van ouderen met een colorectaal carcinoom in klinische trials. De fysiologie van de oudere patiënt is wezenlijk anders dan die van de jongere en met het stijgen van de leeftijd neemt het percentage patiënten met (multipele) comorbiditeit toe. Specifieke comorbiditeit vergroot niet alleen de kans op een complicatie in het betreffende orgaansysteem, maar ook op een complicatie in de overige systemen. Daarnaast verlopen complicaties bij ouderen met comorbiditeit vaak ernstiger en leiden vaker tot overlijden.
In de huidige praktijk lijkt de chirurg bij het maken van een behandelplan zich vooral te laten leiden door de kalenderleeftijd van de patiënt. Dit terwijl uit DSCA-gegevens blijkt dat comorbiditeit de belangrijkste voorspellende factor is voor het postoperatieve beloop. De uitdaging ligt in het voor de clinicus hanteerbaar maken van comorbiditeit als instrument voor risico-inschatting in de dagelijkse praktijk. Er wordt toenemend gedacht dat het bepalen van de ‘kwetsbaarheid’ (frailty) een centrale rol speelt bij het maken van de juiste risico-inschatting. Dit jaar zal er een pilot van start gaan die de frailty-index als risicomaat gaat onderzoeken.
Neo-adjuvante therapie
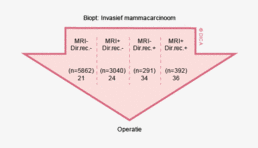
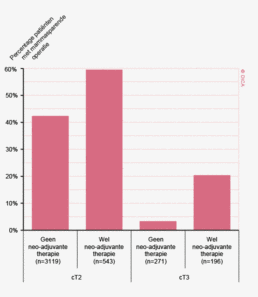
Bij het laag stadium rectumcarinoom (cT1-2N0) was er in Nederland sprake van overbehandeling met neo-adjuvante radiotherapie die zelfs toenam tot 2011, maar in 2012 is nu een daling gezien (81% in 2011 en 62% in 2012). Ook wordt er in de DSCA een neiging tot overstadiëring op basis van de MRI geconstateerd. Het betreft de fout-positieve beoordeling van de aanwezigheid van metastasen in de lymfeklieren. In de groep patiënten bij wie geen stadiumverlaging door middel van neo-adjuvante therapie kon worden bewerkstelligd, waren bij een vermoeden op tumorpositieve klieren (N+) in 50% van de gevallen de klieren achteraf toch niet aangedaan. Deze overschatting van het N-stadium op basis van MRI, werkt overbehandeling in de hand. Dit suggereert een noodzaak tot verdere standaardisatie van de MRI-beoordeling ten aanzien van het N-stadium. Aangezien sommige ziekenhuizen met hun MRI een betere inschatting van het N-stadium blijken te maken dan andere, lijkt er een aanzienlijke verbetering mogelijk.
De resultaten van de zogenoemde ‘M1 studie’ hebben geleid tot een toename in het gebruik van het korte schema radiotherapie gevolgd door systemische chemotherapie, met name in opleidings- en academische ziekenhuizen. Een andere ontwikkeling, die met name in de academische ziekenhuizen wordt gezien, is een langer interval tussen chemoradiotherapie en chirurgie (merendeels meer dan 10 weken). Dit komt doordat er in de literatuur aanwijzingen zijn dat een verlenging van dit interval, bij bepaalde groepen patiënten, betere resultaten geeft. Indien na chemoradiotherapie nog steeds sprake is van een T4-stadium blijkt er een hoge kans op een irradicale resectie. Voor identificatie van deze patiënten die niet (goed) reageren op radiotherapie en voor het optimaliseren van de chirurgie in dergelijke gevallen, lijkt dus extra aandacht vereist.
Afsluiting
Het vierde DSCA-registratiejaar is met succes afgerond. Door de enorme inzet van de deelnemers registreerden dit jaar alle ziekenhuizen een geschat percentage van 97% van de daarvoor in aanmerking komende patiënten in de DSCA. Een grote uitdaging voor de toekomst zal zijn om de -met oncologische colorectale chirurgie samenhangde- postoperatieve morbiditeit en mortaliteit verder omlaag te brengen. Hiertoe zal getracht worden kwetsbare groepen patiënten beter te identificeren. Zo zal dit jaar een frailty-index worden geïmplementeerd in de DSCA-registratie. Verder kunnen nieuwe inzichten met betrekking tot neo-adjuvante therapie bij patiënten met een rectumcarcinoom leiden tot betere oncologische en functionele uitkomsten. Het multidisciplinaire karakter van de behandeling van het colorectaal carcinoom vereist een verdere samenwerking van de verschillende specialismen binnen de DSCA.
Datacollectie en datacontrole
SummarySamenvatting
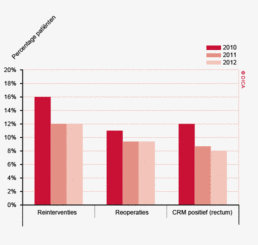
- In 2012 namen alle Nederlandse ziekenhuizen deel aan de DSCA, in 2011 waren dat nog 91 van de 92 ziekenhuizen.
- Niet eerder werden er in een jaar zoveel patiënten in de DSCA geregistreerd; met 10.017 patiënten wordt de volledigheid in 2012 geschat op 97%. In 2011 is, in vergelijking met de gegevens in de NKR 2011, 94% van alle resecties geregistreerd.
- Ook de volledigheid op individueel ziekenhuis-niveau is verder verbeterd. Bij circa de helft van de ziekenhuizen is het verschil in het aantal resecties in de DSCA en de NKR minder dan 5%.
- De vergelijkingen van de patiënt-, tumor- en behandelingskarakteristieken laten zien dat er in het algemeen geen grote verschillen zijn tussen de in de DSCA en de NKR geregistreerde gegevens. De items ‘histologie’ en ‘neo-adjuvante therapie’ tonen de grootste discrepantie. In de NKR worden vooral meer mucineuze tumoren geregistreerd (12% tegenover 3,6 %). De verschillen in neo-adjuvante therapie zijn mogelijk veroorzaakt door een wisselende interpretatie van de definities. Dit is in 2012 verholpen door veranderingen in het online datacollectiesyteem.
- In de DSCA worden alleen de ‘darmnaadlekkages’ geregistreerd die leiden tot een reïnterventie. De rapportage blijkt dan ook te verschillen tussen de DSCA en NKR; 6,9% tegenover 9,5%.
- De uitkomsten in de DSCA en de NKR zijn voor het eerst ook vergeleken op individueel ziekenhuisniveau, voor wat betreft de indicatoren ‘lymfeklierevaluatie’ en ‘30-dagenmortaliteit’. Voor beide items zijn er discrepanties, waarbij er soms een overrapportage in de NKR en soms in de DSCA wordt geconstateerd. De uitdaging is om, op weg naar volledige transparantie van de DSCA-resultaten, te onderzoeken waar deze verschillen op ziekenhuisniveau vandaan komen.
- De sterk dalende trend in 30-dagenmortaliteit sinds de start van de DSCA, is in beide registraties te zien. In de NKR daalde de mortaliteit voor patiënten met een coloncarcinoom in 3 jaar met meer dan 25%, van 5,5% in 2009 naar 4,1% in 2011. In de DSCA van 4,5% naar 3,4%. Voor patiënten met een rectumcarcinoom daalde de mortaliteit in de NKR van 2,6% naar 2,3%, in de DSCA van 2,4% naar 2,2%.
Voor een goede en betrouwbare vergelijking van patiëntkenmerken, behandelingen en uitkomsten van zorg tussen ziekenhuizen is het van groot belang dat de geregistreerde data volledig en correct zijn. De betrouwbaarheid van de geregistreerde kwaliteitsinformatie is een van de belangrijkste kernwaarden van de DSCA. Door eenduidige definities, foutenrapportages en vergelijkingen met externe databases zoals die van de Nederlandse Kankerregistratie (NKR) controleert de DSCA de juistheid van de verzamelde kwaliteitsinformatie.
Het verifiëren van de volledigheid en correctheid van de geregistreerde gegevens kan op meerdere niveaus gebeuren. In dit hoofdstuk komen de volgende punten aan bod:
- Participeren alle ziekenhuizen in Nederland in de DSCA?
- Zijn alle te includeren patiënten ook daadwerkelijk ingevoerd door de ziekenhuizen?
- Zijn de registratiegegevens volledig ingevuld?
- Zijn de registratiegegevens correct ingevuld, op populatieniveau en op individueel ziekenhuisniveau?
De DSCA heeft de mogelijkheid om zijn gegevens te spiegelen aan die van de Nederlandse Kankerregistratie (NKR) 1. Met deze vergelijking kan er kritisch gekeken worden naar de punten waarop de DSCA-gegevens van die van de NKR verschillen en kunnen mogelijk redenen daarvoor achterhaald worden. Hiermee toont de DSCA zich toetsbaar, wat een belangrijk uitgangspunt van de audit vormt.
Deelnemers
In 2009 registreerde 84 van de 94 ziekenhuizen zijn patiënten in de DSCA. In 2011 is dit opgelopen naar 91 van de 92 ziekenhuizen. Deelname aan de DSCA is een kwaliteitsnorm van de Nederlandse Vereniging voor Heelkunde (NVvH) en onderdeel van de multidisciplinaire kwaliteitsnormen van de Samenwerkende Oncologische Specialismen (SONCOS). Bovendien is het een prestatie-indicator van de Inspectie voor de Gezondheidszorg (IGZ), aan wie jaarlijks het percentage in de DSCA geregistreerde patiënten, geopereerd vanwege een primair colorectaal carcinoom, moet worden aangeleverd2.
In 2012 participeerden alle 92 Nederlandse ziekenhuizen in de DSCA-registratie. Bij het sluiten van de dataset op 12 februari 2013 waren 10.017 patiënten met de operatiedatum in 2012 geregistreerd in de DSCA. Dit aantal was niet eerder zo hoog.
Inclusie
De NKR registreert alle nieuwe gevallen van kanker in Nederland. Deze gegevens zijn circa negen maanden na de diagnose beschikbaar, waardoor we in dit hoofdstuk over het jaar 2011 zullen rapporteren. In 2011 werden in Nederland 13.254 patiënten met een colorectaal carcinoom gediagnosticeerd3. De DSCA registreert alleen patiënten die in verband met de diagnose colorectaal carcinoom een darmresectie ondergaan. In 2011 betrof dit 9.712 patiënten.
De NKR registreerde dat jaar 10.364 resecties, waarmee de volledigheid van de DSCA naar schatting 94% bedraagt en opnieuw is opgelopen ten opzichte van het vorige registratiejaar.
Database
Uit de validatie van de totale groep in de DSCA geregistreerde patiënten blijkt dat de volledigheid van de per patiënt geregistreerde gegevens in de DSCA elk jaar verder toeneemt. In tabel 1 zijn de items weergegeven met het hoogste percentage ontbrekende gegevens. Dit zijn grotendeels items die ook in de eerste registratiejaren niet volledig waren en over de jaren steeds completer zijn ingevuld. Het registreren van de circumferentiële resectiemarge (CRM) bij het rectumcarcinoom en het preoperatieve multidisciplinaire overleg (MDO) is zichtbaar verbeterd ten opzichte van voorgaande jaren. Deze twee items gelden als kwaliteitsindicator bij het rectumcarcinoom (zie hoofdstuk 3 “Kwaliteitsindicatoren”). Er is echter nog steeds ruimte voor verbetering. In tabel 1 is dan ook te zien dat bij meer dan 5% van de patiënten een aantal items nog niet wordt ingevuld. Ook zijn er enkele onderdelen minder compleet geregistreerd ten opzichte van vorig jaar. Dit kan nog veranderen na terugkoppeling van de ontbrekende gegevens aan de ziekenhuizen door middel van de foutenrapportage op mijnDSCA.
| Item | 2010 | 2011 | 2012 |
| % | % | % | |
| CRM* | 42% | 22% | 11% |
| Lengte | 19% | 7,1% | 12% |
| Extramurale invasie | 18% | 7,1% | 6,5% |
| Datum MDO* | 18% | 12% | 6,0% |
| Gewicht | 17% | 6,2% | 12% |
| Afstand tumor tot anus | 16% | 10% | 9,2% |
| Datum biopt | 12% | 5,8% | 4,3% |
| cTNM* | 11% | 8,4% | 1,4% |
| Radicaliteit (R0, R1, R2) | 10% | 1,3% | 2,9% |
| Preoperatieve tumorcomplicaties | 7,9% | 2,6% | 0,0% |
| Aanvullende resectie metastasen | 7,4% | 0,6% | 0,2% |
| Aanvullende resecties doorgroei | 6,8% | 3,6% | 11% |
| Adjuvante chemotherapie ** | 6,9% | 2,9% | 0,6% |
| Histologie | 5,0% | 2,3% | 12% |
| Datum start neo-adjuvante therapie | 44% | 33% | 29% |
Validatie op populatieniveau
In tabel 2 worden gegevens over patiënt-, tumor- en behandelkarakteristieken van de DSCA en de NKR met elkaar vergeleken. Hierbij wordt alleen gekeken naar items die in beide databases beschikbaar zijn, aangezien de DSCA een groot aantal items bevat die de NKR niet registreert.
| Item | DSCA 2011 | NKR 2011* | |
| Geslacht | |||
| Man | 55% | 55% | |
| Leeftijd | |||
| 60 en jonger | 20% | 21% | |
| 61 - 70 | 29% | 30% | |
| 71 - 80 | 33% | 33% | |
| 81 en ouder | 18% | 16% | |
| Colon - of rectumcarcinoom^ | |||
| Colon | 71% | 71% | |
| Rectum | 29% | 29% | |
| Tumorlocalisatie coloncarcinoom | |||
| Caecum | 20% | 21% | |
| Appendix | 0,6% | 1,1% | |
| Colon ascendens | 18% | 15% | |
| Flexura hepatica | 6,6% | 6,3% | |
| Colon transversum | 6,8% | 8,1% | |
| Flexura lienalis | 3,1% | 4,2% | |
| Colon descendens | 6,1% | 4,4% | |
| Sigmoid | 39% | 40% | |
| Histologie | |||
| Adenocarcinoom | 94% | 87% | |
| Mucineus carcinoom | 3,6% | 12% | |
| Zegelringcelcarcinoom | 0,5% | 0,9% | |
| Overig | 2,2% | 0,6% | |
| Locatie metastasen | |||
| Geen | 88% | 87% | |
| Lever | 5,6% | 6,4% | |
| Longen | 0,8% | 0,9% | |
| Meerdere lokaties | 2,3% | 2,8% | |
| Overig | 1,8% | 3,0% | |
| Onbekend | 1,0% | 0,0% | |
| Voorbehandeling rectumcarcinoom | |||
| Geen (geregistreerd) | 14% | 12% | |
| Radiotherapie kort | 47% | 48% | |
| Chemoradiatie | 30% | 38% | |
| Radiotherapie lang | 9,5% | 2,0% | |
| Urgentie operatie coloncarcinoom | |||
| Electief/urgent | 93% | 92% | |
| Acuut (<12 uur) | 7,3% | 8,3% | |
| Benadering | |||
| Open | 60% | 59% | |
| Laparoscopisch totaal | 34% | 34% | |
| Scopisch met conversie | 6,2% | 7,3% | |
| Type resectie | |||
| Ileocoecaal/hemicolectomie links + rechts | 40% | 40% | |
| Transversum | 2,3% | 2,0% | |
| Sigmoid/Anteriorresectie | 45% | 45% | |
| APR | 8,8% | 9,1% | |
| Subtotale colectomie | 1,8% | 2,0% | |
| Overig | 1,9% | 1,3% | |
| Uitkomsten | |||
| Naadlekkage** | 6,9% | 9,5% | |
| 30 dgn mortaliteit | 3,0% | 3,6% | |
| CRM rectumcarcinoom | |||
| Niet radicaal*** | 8,5% | 7,8% | |
| Onbekend | 20% | 16% | |
| Totaal aantal lymfeklieren | 10 of meer | 79% | 78% |
| Onbekend | 1,0% | 1,3% | |
| Aantal positieve lymfeklieren | 0 | 59% | 59% |
| 1 | 12% | 12% | |
| 2 tot 3 | 12% | 12% | |
| 4 tot 6 | 8,0% | 8,2% | |
| >6 | 7,7% | 7,2% | |
| Onbekend | 0,9% | 1,4% | |
| Adjuvante therapie coloncarcinoom | HIPEC | 1,4% | 1,1% |
| Adjuvant | 34% | 31% | |
| pTNM | (y) T0/Tx | 4,8% | 4,0% |
| (y) T1 | 6,3% | 6,7% | |
| (y) T2 | 20% | 19% | |
| (y) T3 | 56% | 56% | |
| (y) T4 | 13% | 14% | |
| N0 | 58% | 58% | |
| N1 | 25% | 26% | |
| N2 | 15% | 16% | |
| Nx | 2,2% | 1,2% | |
| M0/X | 89% | 93% | |
| M1 | 11% | 7,0% | |
| Stadium | 0-I | 24% | 24% |
| II | 32% | 33% | |
| III | 31% | 36% | |
| IV | 11% | 7,0% | |
| X | 1,1% | 0,6% |
Casemix
Een valide en complete registratie van de factoren die de zorgzwaarte van de behandelde patiëntengroep karakteriseren, is nodig voor een casemixcorrectie van de gerapporteerde uitkomstindicatoren. In een publicatie met DSCA-data door Kolfschoten c.s. werd eerder al aangetoond dat de casemix van Nederlandse ziekenhuizen aanzienlijk verschilt4. Omdat deze gegevens in het voorgaand jaarrapport uitgebreid gecontroleerd zijn en deze goed overeenkwamen, wordt de validatie op populatieniveau dit jaar niet gerapporteerd.
Neo-adjuvante therapie
Opvallend zijn de discrepanties in de DSCA en de NKR in de percentages neo-adjuvante therapie bij patiënten met een rectumcarcinoom. Het percentage patiënten dat voorbehandeld wordt met langdurige radiotherapie is in de DSCA duidelijk hoger dan in de NKR. Dit heeft waarschijnlijk met een wisselend geïnterpreteerde definitie te maken, waarbij chemoradiatie soms als langdurige radiotherapie werd geregistreerd. Nadat dit in de jaarrapportage 2011 was gesignaleerd, zijn de keuzeopties in het registratiesysteem van de DSCA aangepast om dit probleem te ondervangen. De patiënten bij wie langdurige radiotherapie en chemotherapie apart zijn geregistreerd, werden voor de analyses in dit jaarrapport verplaatst naar de groep chemoradiatie (zie hoofdstuk 7 “Neo-adjuvante therapie”.) Dit gebeurde na overleg in de wetenschappelijke commissie.
Pathologie
Zoals in eerdere rapportages al werd geconstateerd, blijft er een verschil in de rapportage van histologische tumortypen. In de registratie van de NKR komt het mucineus carcinoom aanzienlijk vaker voor. Adenocarcinomen behoren tot de mucineuze tumoren wanneer deze voor meer dan 50% bestaan uit slijmmeren. Dit staat wellicht niet altijd duidelijk omschreven in de conclusie van het PA-verslag, waardoor er verschillen in interpretatie kunnen ontstaan. Het meer betrekken van pathologen bij de registratie of het gebruik van PALGA-protocollen zou de registratie kunnen verbeteren.
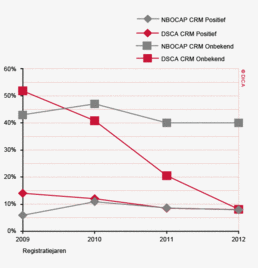
Het eerder geconstateerde verschil tussen de DSCA en de NKR in ontbrekende gegevens over de CRM bij resecties voor rectumcarcinoom, is afgenomen. De CRM is een belangrijke parameter voor de kwaliteit van de rectumchirurgie. De DSCA heeft hier in de voorgaande jaren veel aandacht aan besteed. Ook is het rapporteren van de CRM in de DSCA een kwaliteitsindicator van Zichtbare Zorg geworden, wat de verbeterde kwaliteit van de registratie kan verklaren ( zie ook hoofdstuk 4 "Pathologie".)
Morbiditeit en mortaliteit
Er blijft discrepantie bestaan tussen de DSCA en de NKR in de rapportage van darmnaadlekkage na colorectale operaties. Het begrip ‘darmnaadlekkage’ is gevoelig voor definitie- en interpretatieverschillen waardoor dit verschil kan ontstaan5. Bovendien worden in de DSCA alleen die naadlekkages gerapporteerd die leiden tot een reïnterventie.
Ook wordt er een verschil gezien in 30-dagenmortaliteit. In de DSCA is het ziekenhuis waarin de patiënt wordt geopereerd verantwoordelijk voor de registratie. Wanneer een patiënt overlijdt na ontslag uit het ziekenhuis of na overplaatsing naar een ander ziekenhuis, wordt de registratie mogelijk gemist. Het ziekenhuis blijft voor de DSCA echter verantwoordelijk voor een correcte registratie, ook van patiënten die buiten het ziekenhuis zijn overleden. Door in de toekomst verschillen met de NKR terug te koppelen aan de ziekenhuizen via mijnDSCA, kan de registratie hierin verbeteren. Het verschil in mortaliteit tussen de NKR en DSCA is in relatieve zin wel gelijk gebleven. Beide registraties laten sinds 2009 een duidelijk dalende trend zien van de mortaliteit na colorectale chirurgie (zie figuur 1).
Volledigheid op ziekenhuisniveau
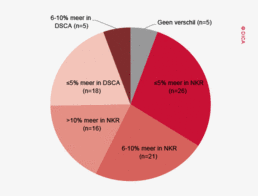
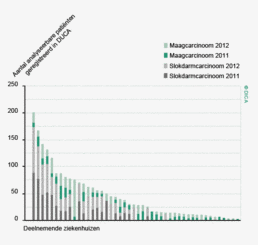
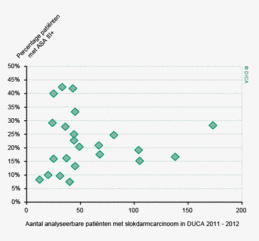
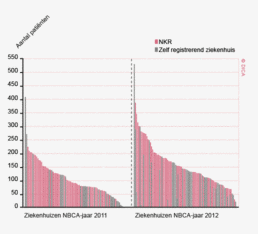
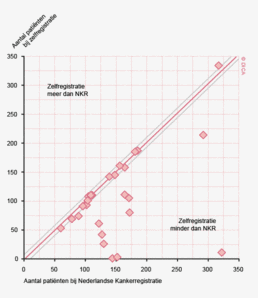
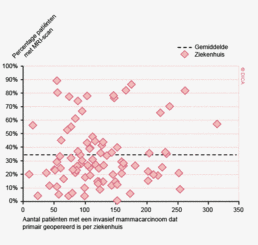
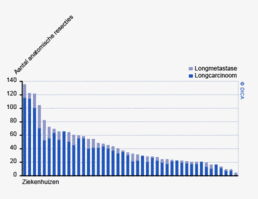
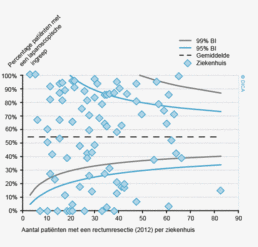
In figuur 2 is een vergelijking weergegeven van het aantal geregistreerde resecties voor primair colorectaal carcinoom in de DSCA en in de NKR in het registratiejaar 2011. Er zijn 5 ziekenhuizen waarbij geen verschil wordt gezien tussen beide databases. In de DSCA werden door 22 ziekenhuizen meer resecties ingevoerd dan er geregistreerd staan in de NKR in 2011. Hiervan is bij de meerderheid van de ziekenhuizen het verschil 5% of minder. Dit verschil zou deels kunnen ontstaan door verschillen in het toepassen van in- en exclusiecriteria. Soms is er bijvoorbeeld onduidelijkheid of een tumor primair in de darm is ontstaan, of dat er sprake is van een tumor ontstaan in een ander orgaan, maar doorgegroeid in de darm. Er zijn 64 ziekenhuizen die minder resecties hebben ingevoerd in de DSCA ten opzichte van de NKR. Bij 17 ziekenhuizen was dit verschil 10% of meer, wat een verbetering is ten opzichte van 2010.
Uitkomsten op ziekenhuisniveau
Voor het eerst is er dit jaar gekeken naar verschillen in uitkomsten op ziekenhuisniveau. Per ziekenhuis zijn twee indicatoren berekend op basis van de gegevens geregistreerd in de DSCA en op basis van de NKR. Het betreft ‘het percentage patiënten bij wie 10 of meer lymfeklieren werden onderzocht na colonresectie’ en ‘30-dagenmortaliteit’.
Verschillen tussen de DSCA en de NKR kunnen meerdere oorzaken hebben. Een indicator bestaat uit een teller en een noemer. Discrepanties in een van deze coëfficiënten kan leiden tot een afwijkende indicatoruitkomst. Mogelijke oorzaken kunnen zijn: verschillen in het aantal geregistreerde patiënten, verschillen in geregistreerde tumorlocatie – colon of rectum - en verschillen in interpretatie van bijvoorbeeld het PA-verslag (onderzochte lymfeklieren, CRM).
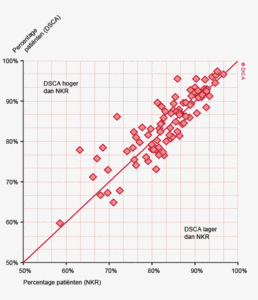
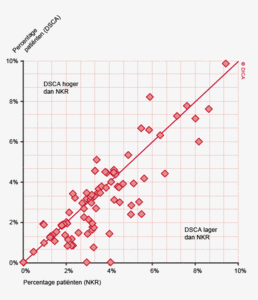
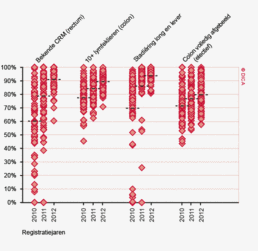
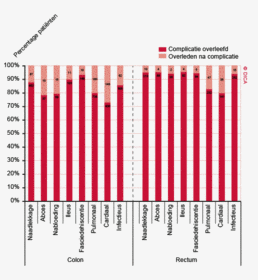
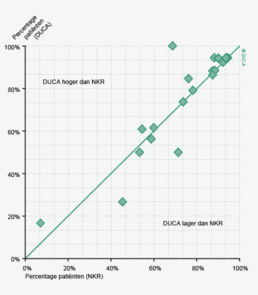
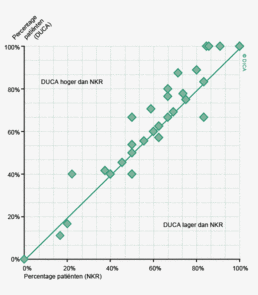
Figuur 3a/b tonen de resultaten per ziekenhuis, waarin de resultaten van de DSCA en de NKR in een grafiek tegen elkaar uitgezet worden. Er is geen verschil in de indicatoruitkomst wanneer een ziekenhuis zich op de diagonale (doorgetrokken) lijn bevindt. Indien het ziekenhuis zich boven de diagonaal bevindt, is de geregistreerde uitkomst hoger in de DSCA dan in de NKR. Onder de lijn is de uitkomst hoger in de NKR dan in de DSCA.
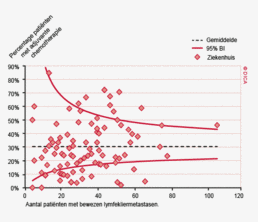
Lymfeklieren
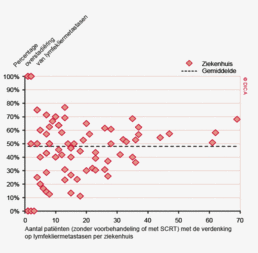
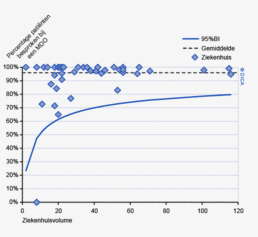
In figuur 3a worden de twee registraties tegen elkaar afgezet voor het aantal onderzochte lymfeklieren. Een punt boven de doorgetrokken lijn betekent dat het desbetreffende ziekenhuis een hoger percentage patiënten met 10 of meer onderzochte lymfeklieren in de DSCA heeft ingevoerd ten opzichte van het percentage dat geregistreerd werd door de NKR. Een punt onder de diagonale lijn betekent dat dit percentage in de DSCA lager is dan in de NKR. We zien dat er nog al wat verschillen zijn, waarbij er een min of meer gelijke verdeling is tussen onder- en overregistrerende ziekenhuizen. Naarmate meer ziekenhuizen overgaan op de zogenaamde PALGA-protocollen, waarbij de patholoog gestandaardiseerd verslag legt over het aantal verwijderde, onderzochte en tumorpositieve klieren, zullen deze verschillen in interpretatie naar onze mening afnemen.
Mortaliteit
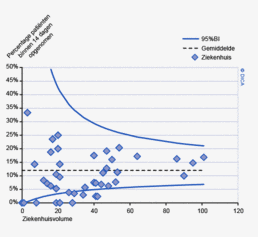
Figuur 3b bekijkt het verschil op ziekenhuisniveau in 30-dagenmortaliteit. In de DSCA wordt mortaliteit gedefinieerd als ‘overlijden binnen 30 dagen na de resectie of in dezelfde opname waarin de resectie plaats gevonden heeft (ziekenhuissterfte)’. Een patiënt kan immers ook na 30 dagen nog overlijden aan de complicaties van de operatie. In de NKR is ziekenhuissterfte echter niet beschikbaar, waardoor alleen een vergelijking van de 30-dagenmortaliteit mogelijk is.
De figuur laat zien dat er zowel ziekenhuizen zijn die een hogere 30-dagenmortaliteit rapporteerden aan de DSCA dan geregistreerd werd in de NKR, als ziekenhuizen die op deze indicator een lager percentage rapporteerden. Ook hier vinden we een min of meer gelijke verdeling boven en onder de diagonaal, maar er zijn ook twee ziekenhuizen die geen 30-dagenmortaliteit aan de DSCA melden, terwijl de NKR er een mortaliteit van respectievelijk 2 en 4% constateert. Deze mortaliteitspercentages zijn niet alarmerend hoog, maar de discrepanties met de NKR zullen alsnog aan deze ziekenhuizen worden teruggekoppeld om de oorzaken van mogelijke onderregistratie te achterhalen. Hoewel een definitieverschil voor ‘mortaliteit’ onwaarschijnlijk is, bestaat er de mogelijkheid dat een verkeerde overlijdensdatum is ingevuld of dat patiënt is overleden buiten het eigen ziekenhuis, zonder dat de behandelaar hiervan op de hoogte was. De NKR verkrijgt overlijdensdata uit de Gemeentelijke Basisadministratie en zal daarom vollediger zijn in het vaststellen van 30-dagenmortaliteit6.
Conclusie
De gegevens over de behandeling van colorectale tumoren komen goed overeen tussen de DSCA en de NKR. Er zijn echter wel verschillen op ziekenhuisniveau die aan de deelnemers terug gekoppeld zullen worden om de oorzaken hiervan te achterhalen. Door nog verdergaande dataverificatie, het koppelen van de DSCA aan de brongegevens in de ziekenhuizen en een intensievere samenwerking met IKZ en IKNL hopen we in de toekomst de datakwaliteit nog verder te kunnen verbeteren.
Referenties
1.Resultaten
SummarySamenvatting
- In 2012 werden 9.946 analyseerbare patiënten geregistreerd in de DSCA. Dit betreft 6.750 patiënten met een coloncarcinoom, 2.806 met een rectumcarcinoom en 390 met een dubbeltumor.
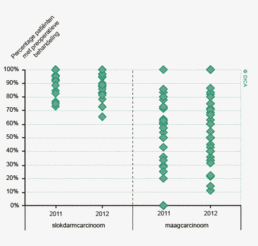
- De eerder geconstateerde verbetering in het volgen van de richtlijnen betreffende het preoperatieve traject, zette in 2012 verder door. Dit is te zien aan het hoge percentage patiënten met een colorectaal carcinoom waarbij de preoperatieve beeldvorming volledig is en het hoge percentage patiënten wat preoperatief wordt besproken in een multidisciplinair overleg, namelijk 97% van de patiënten met een rectumcarcinoom.
- Sinds 2009 blijft het percentage laparoscopisch uitgevoerde colorectale resecties toenemen. Zowel bij colon- als rectumcarcinomen vindt de resectie bij de helft van de patiënten plaats met een scopische techniek. Het percentage waarbij de scopische resectie wordt geconverteerd naar een open benadering is daarbij gelijk gebleven. Dit aandeel laparoscopische colorectale chirurgie ligt internationaal gezien zeer hoog.
- Sinds de start van de DSCA-registratie is er een continue verbetering van de uitkomsten van de colorectale chirurgie in Nederland te zien. Ook in 2012 is het percentage irradicale resecties verder afgenomen. Voor patiënten met een coloncarcinoom nam het percentage af van 4,6% in 2009 naar 3% in 2012. Voor patiënten met een rectumcarcinoom nam dit percentage af van 14% naar 8%.
- Ook de postoperatieve morbiditeit en mortaliteit zijn opnieuw lager in 2012 dan in de voorgaande jaren. Voor patiënten met een coloncarcinoom daalde de ziekenhuismortaliteit van 4,5% naar 3,2%; voor patiënten met een rectumcarcinoom daalde dit percentage van 2,4% naar 1,5%. Dit betekent een absolute daling van 109 sterfgevallen per jaar.
- Hoewel de wachttijden de afgelopen jaren verbeterden, wordt nog steeds een aanzienlijk deel van de patiënten niet volgens de Treeknorm, binnen 7 weken, behandeld. Van de patiënten met een coloncarcinoom wordt 88% binnen 7 weken behandeld, dit betrof 86% in 2009. Van de patiënten met een rectumcarcinoom wordt bij 79% binnen 7 weken gestart met de behandeling, dit betrof 73% in 2009. Er wordt een behoorlijke spreiding in wachttijden gezien tussen de ziekenhuizen.
- De mediane opnameduur is verminderd. Patiënten met een coloncarcinoom liggen mediaan 7 dagen opgenomen in het ziekenhuis, dit was 8 dagen in 2009. Patiënten met een rectumcarcinoom liggen mediaan 8 dagen in het ziekenhuis, dit was 10 dagen in 2009. Deze vermindering in het aantal opnamedagen zal een aanzienlijke besparing voor de zorgkosten betekenen.
Registratie indicatie
In 2013 is er een uitbreiding van de indicaties voor registratie in de DSCA. Alle primaire rectumtumoren, waarvoor een wait-and-see-strategie is afgesproken (ook zonder resectie) worden nu ook geregistreerd.
De Nederlandse gezondheidszorg behoort kwalitatief tot één van de best presterende zorgsectoren in Europa. De betaalbaarheid van ons gezondheidszorgsysteem wordt echter steeds vaker ter discussie gesteld. In navolging van het Zweedse systeem van kwaliteitsregistraties is in 2009 de DSCA opgestart, met als primair doel het verbeteren van de kwaliteit van de zorg, maar daarnaast is ook het verlagen van de zorgkosten een belangrijke doelstelling. Bij volledige implementatie van kwaliteitsregistraties in het Nederlandse gezondheidszorgsysteem zou dit kunnen leiden tot een jaarlijkse besparing van 2,3 miljard euro. Dit constateert de Boston Consulting Group in het rapport Zorg voor Waarde dat in 2011 gepubliceerd werd1.
Het Zweedse systeem kent meer dan 80 breed gedragen ‘clinical audits’, die met transparantie van ziekenhuisspecifieke zorguitkomsten hebben bijdragen aan een positie in de internationale top op het gebied van kwaliteit en kosteneffectiviteit van de zorg. De DSCA is een blauwdruk voor Nederlandse uitkomstregistraties, waarin door continue feedback van ‘gebenchmarkte’ uitkomstgegevens aan behandelaars en hun ziekenhuizen, de zorg continu kan worden verbeterd. De verwachting is dat hiermee een vergelijkbaar effect ontstaat op de kwaliteit van zorg in Nederland, als in de Zweedse gezondheidszorg heeft plaatsgevonden. Op meerdere plaatsen in dit jaarrapport zal getoond worden hoe de DSCA zich al verdienstelijk toont in het realiseren van de beoogde kwaliteitsverbeteringen.
In dit hoofdstuk worden de basale cijfers van het zorgproces rondom patiënten met een colorectaal carcinoom besproken, waarbij patiënten met een colon- en een rectumtumor apart bekeken worden.
Patiënten
De DSCA bevat over het jaar 2012 in totaal 10.017 patiënten, waarvan er 9.946 analyseerbaar zijn (99%). Dit betreft 6.750 patiënten (68%) met een coloncarcinoom, 2.806 patiënten (28%) met een rectumcarcinoom en 390 patiënten (4%) met een dubbeltumor. Deze laatste groep wordt niet meegenomen in de hier gepresenteerde analyses. Om in de DSCA database ingevoerde patiëntengegevens te kunnen analyseren, is een minimum aan ingevulde items nodig. Patiënten worden uitgesloten van de analyses in dit jaarrapport wanneer de locatie van de tumor (colon of rectum), de operatiedatum en/of de overlevingsstatus niet bekend zijn. In 2012 is bij 12 patiënten de locatie van de tumor en bij 62 de overlevingsstatus niet ingevuld. De operatiedatum is bij alle patiënten bekend.
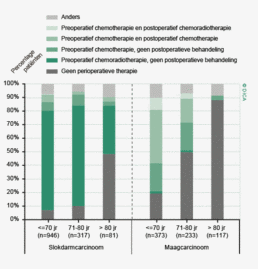
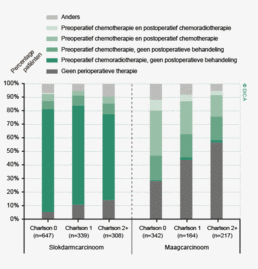
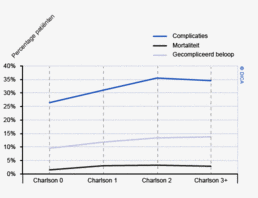
De patiënt- en tumorkarakteristieken van 2012 komen overeen met die van voorgaande jaren. Hieruit valt te concluderen dat de gegevens in de DSCA een betrouwbare weergave zijn van de patiëntenpopulatie met een primair colorectaal carcinoom, waarvoor resectie heeft plaatsgevonden (tabel 1). De gemiddelde leeftijd van patiënten in de DSCA is 71 jaar voor patiënten met een coloncarcinoom en 67 jaar voor patiënten met een rectumcarcinoom. Bij het coloncarcinoom is de man/vrouw-verdeling nagenoeg gelijk, het rectumcarcinoom komt vaker voor bij mannen (61% versus 39%). Patiënten bij wie een coloncarcinoom wordt gereseceerd hebben gemiddeld meer comorbiditeit dan patiënten met een rectumcarcinoom (51 versus 42% met een Charlsonscore van 1 of hoger) en een hogere ASA-score (27 versus 17% ASA III of hoger). De Body Mass Index komt voor beide groepen nagenoeg overeen.
| colon | rectum | |||
| aantal | % | aantal | % | |
| 2012 | 2012 | 2012 | 2012 | |
| N | 6750 | 2806 | ||
| Leeftijd | ||||
| Gemiddeld | 71 jaar | 67 jaar | ||
| >70 jaar | 3887 | 58% | 1218 | 43% |
| Geslacht | ||||
| Man | 3478 | 52% | 1701 | 61% |
| Vrouw | 3272 | 49% | 1105 | 39% |
| ASA | ||||
| I - II | 4969 | 74% | 2327 | 83% |
| III | 1647 | 25% | 456 | 16% |
| IV - V | 119 | 1,8% | 22 | 0,8% |
| Charlson score | ||||
| 0 | 3322 | 49% | 1618 | 58% |
| 1 | 1596 | 24% | 597 | 21% |
| >2 | 1832 | 27% | 591 | 21% |
| Body Mass Index | ||||
| Gemiddeld | 26 | 26 | ||
| <25 kg/m2 | 1943 | 29% | 720 | 26% |
| 25-30 kg/m2 | 2014 | 30% | 918 | 33% |
| >30 kg/m2 | 964 | 14% | 411 | 15% |
| Onbekend | 1829 | 27% | 757 | 27% |
| Voorgeschiedenis | ||||
| Buikoperatie | ||||
| Ja | 2389 | 35% | 882 | 31% |
Stadiëring
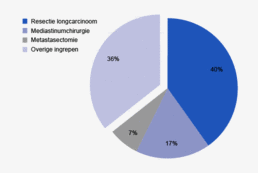
Bij de stadiëring van colon- en rectumcarcinomen wordt gebruik gemaakt van de TNM 5-classificatie, die beschreven wordt op oncoline2. In tabel 2 wordt de stadiumverdeling getoond. Bij 13% van de patiënten die een resectie ondergaan vanwege een coloncarcinoom is er reeds sprake van metastasen. Bij het rectumcarcinoom is dit 7,1%. Deze cijfers komen overeen met voorgaande jaren. Een deel van deze ingrepen zullen palliatieve resecties betreffen, maar er is ook een deel van de patiënten met stadium IV dat in opzet curatief wordt geopereerd. In de DSCA worden alleen de resecties geregistreerd van metastasen voorafgaand aan de resectie van de primaire tumor of gelijktijdig met de resectie van de primaire tumor. Een metastasectomie wordt geregistreerd bij 3,6% van de patiënten met een coloncarcinoom en bij 2,6% van de patiënten met een rectumcarcinoom (tabel 3). Een deel van de patiënten ondergaat echter na de resectie van de primaire tumor, in een latere operatie, alsnog een in opzet curatieve behandeling van de aanwezige metastasen. Deze ingrepen worden niet in de DSCA geregistreerd. Het totale percentage patiënten met een stadium IV colorectaal carcinoom is hoger in de populatie, doordat tot nu toe alleen de patiënten die een resectie ondergaan in de DSCA worden geregistreerd.
| Colon | Rectum | |||
| aantal | % | aantal | % | |
| 2012 | 2012 | 2012 | 2012 | |
| Tumorlocatie | ||||
| Rechter colon | 3019 | 45% | ||
| Transversum | 761 | 11% | ||
| Linker colon | 402 | 6,0% | ||
| Sigmoid | 2568 | 38% | ||
| Afstand tumor - anus | ||||
| < 5 cm | 1008 | 38% | ||
| 5 - 10 cm | 1042 | 40% | ||
| > 10 cm | 577 | 22% | ||
| Urgentie | ||||
| Electief (evt na stent) | 5437 | 81% | 2750 | 98% |
| Urgent + acuut | 1307 | 19% | 52 | 1,9% |
| Tumor complicaties preoperatief | ||||
| Perforatie met peritonitis | 128 | 1,9% | 16 | 0,6% |
| Abces | 62 | 0,9% | 8 | 0,3% |
| Ileus | 1081 | 16% | 75 | 2,7% |
| Bloeding/anaemie | 1451 | 22% | 918 | 23% |
| Overig | 398 | 5,9% | 111 | 4,0% |
| Tumorstadium | ||||
| 0 | 99 | 1,5% | 220 | 7,8% |
| I | 1168 | 17% | 921 | 33% |
| II | 2474 | 37% | 691 | 25% |
| III | 2132 | 32% | 768 | 27% |
| IV | 850 | 13% | 198 | 7,1% |
| Stadium X | 27 | 0,4% | 8 | 0,3% |
| Colon | Rectum | |||||||
| aantal | % | % | % | aantal | % | % | % | |
| 2012 | 2012 | 2011 | 2010 | 2012 | 2012 | 2011 | 2010 | |
| Volledige beeldvorming colon* | 4253 | 78% | 76% | 70% | 2368 | 86% | 81% | 76% |
| Beeldvorming rectumtumor | ||||||||
| Endoecho | 20 | 0,7% | 0,5% | 0,0% | ||||
| CT bekken | 129 | 4,6% | 4,7% | 6,5% | ||||
| MRI bekken | 2488 | 89% | 85% | 81% | ||||
| endo-echo+MRI | 81 | 2,9% | nb | nb | ||||
| Beeldvorming lever | 6582 | 98% | 91% | 90% | 2768 | 99% | 92% | 52% |
| Beeldvorming longen | 6368 | 94% | 90% | 84% | 2749 | 98% | 94% | 49% |
| Multidisciplinair overleg* | 4751 | 87% | 77% | 62% | 2673 | 97% | 97% | 91% |
| Chirurgische voorbehandeling (totaal) | 190 | 97% | 97% | 97% | 318 | 89% | 89% | 89% |
| Stoma aangelegd | 69 | 1,0% | 1,2% | 1,0% | 211 | 7,5% | 7,0% | 8,5% |
| Stent geplaatst | 31 | 0,5% | 0,6% | 1,0% | 2 | 0,1% | 0,2% | 0,3% |
| Metastasectomie / RFA | 22 | 0,3% | 0,3% | 0,1% | 59 | 2,1% | 1,9% | 1,1% |
| Overige | 68 | 1,0% | 0,9% | 0,5% | 46 | 1,7% | 2,0% | 1,3% |
| Radiotherapie (totaal) | 2152 | 77% | 86% | 83% | ||||
| SCRT | 943 | 34% | 43% | 45% | ||||
| SCRT-DS | 156 | 5,6% | 4,3% | 3,2% | ||||
| Chemoradiatie | 1053 | 38% | 39% | 35% | ||||
| Type resectie | ||||||||
| Ileocoecaal resectie | 108 | 1,6% | 1,4% | 1,4% | ||||
| Hemicolectomie rechts | 3091 | 46% | 44% | 45% | ||||
| Transversumresectie | 197 | 2,9% | 3,1% | 2,8% | ||||
| Hemicolectomie links | 745 | 11% | 10% | 9,9% | ||||
| Sigmoidresectie of (low) anterior resectie | 2420 | 36% | 37% | 35% | 1846 | 66% | 64% | 62% |
| Abdomino-perineale resectie | 9 | 0,1% | 0,1% | 0,2% | 760 | 27% | 31% | 29% |
| Overig | 180 | 2,7% | 3,7% | 5,9% | 193 | 6,9% | 4,7% | 9,1% |
| Benadering | ||||||||
| Laparoscopie totaal | 3187 | 47% | 42% | 37% | 1612 | 58% | 45% | 36% |
| Laparoscopie, vroege conversie | 348 | 11% | 9,7% | nb | 104 | 6,5% | 6,3% | nb |
| Laparoscopie, late conversie | 108 | 3,4% | 5,0% | nb | 78 | 4,8% | 6,3% | nb |
| Type anastomose | ||||||||
| Naad zonder stoma | 5564 | 84% | 85% | 86% | 401 | 16% | 17% | 18% |
| Naad en stoma | 277 | 4,2% | 4,4% | 3,8% | 940 | 37% | 34% | 34% |
| Stoma zonder naad | 757 | 12% | 10% | 9,8% | 1218 | 48% | 49% | 49% |
| Uitgebreide resecties | ||||||||
| Resecties ivm doorgroei tumor uitgebreid | 287 | 4,3% | 4,4% | 4,9% | 90 | 3,2% | 2,8% | 4,3% |
| Resecties ivm doorgroei tumor beperkt | 391 | 5,8% | 6,5% | 5,1% | 78 | 2,8% | 3,7% | 3,5% |
| Resecties ivm metastasen | 244 | 3,6% | 4,2% | 2,7% | 73 | 2,6% | 2,8% | 2,9% |
Beeldvorming
Tabel 3 toont de kernpunten van het diagnostisch proces, zoals vastgelegd in de landelijke richtlijnen2. Disseminatieonderzoek bij het colorectaal carcinoom behelst onder andere beeldvorming van lever en longen ter uitsluiting van metastasen. In 2012 wordt bij 98% van de patiënten met een coloncarcinoom de lever preoperatief in beeld gebracht en bij 94% de longen. Ditzelfde gebeurt voor respectievelijk 99 en 98% van de patiënten met een rectumcarcinoom. In beide groepen is er een duidelijke verbetering te zien in de toepassing van de preoperatieve beeldvorming, zoals die in de richtlijn wordt geadviseerd.
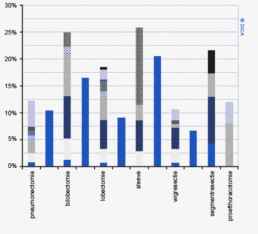
Bij patiënten met een rectumcarcinoom moet daarnaast het kleine bekken gevisualiseerd worden. De richtlijn adviseert hiervoor een MRI-scan, waarmee een goede inschatting gemaakt kan worden van het tumorstadium en de relatie tot de structuren in het bekken. Ook kan er gekozen worden voor endo-echografie, waarmee bij oppervlakkige tumoren goed gedifferentieerd kan worden tussen een T1- en T2-tumor. In 2012 is dit voor 81 patiënten geregistreerd. Verandering in registratie van MRI en endo-echo als aparte beeldvorming zal beter inzicht geven in het gebruik van beide diagnostische technieken. Het percentage patiënten met een rectumcarcinoom waarbij adequate beeldvorming van het bekken plaatsvindt, is opgelopen van 89% in 2009 tot 97% in 2012, voornamelijk door een brede toepassing van MRI. De CT-scan wordt wisselend ingezet voor dit doeleinde, dit percentage ligt tussen de 0 en 43% per ziekenhuis.
Multidisciplinair overleg
Het multidisciplinair overleg (MDO) is een belangrijk instrument om een consistent en gevalideerd behandelplan op te stellen waarbij de patiënt centraal staat. Een MDO heeft een aangetoond kwaliteit verbeterend effect3 4 5. Bij een dergelijke bespreking behoort een colorectaal chirurg, radioloog, MDL-arts, internist-oncoloog en een patholoog aanwezig te zijn. Eventueel kunnen ook nog andere disciplines aan het MDO worden toegevoegd, zoals een nucleair geneeskundige, klinisch geneticus, leverchirurg, interventieradioloog en gespecialiseerd verpleegkundige (bijvoorbeeld stomaverpleegkundige). Inmiddels behoort het preoperatief bespreken van patiënten met een rectumcarcinoom in een multidisciplinair overleg tot de professionele standaard. Waar in 2009 slechts 80% van patiënten met een rectumcarcinoom in een MDO werd besproken, is dit percentage inmiddels opgelopen tot 97% Bij het coloncarcinoom staat het bespreken van patiënten in een preoperatief MDO niet specifiek in de richtlijn. Het percentage patiënten dat in een electieve setting geopereerd wordt en vooraf wordt besproken is in 2012 87%. Voor verdere bespreking van de verbeteringen in de naleving van richtlijnen wordt verwezen naar hoofdstuk 3 ‘Kwaliteitsindicatoren’.
Wachttijden en verwijzing
In 2000 vond het Treekoverleg plaats. Hierbij werd met de betrokken partijen overeenstemming bereikt over streefnormen voor maximale wachttijden voor niet-acute zorg. Volgens deze normen moet 80% van de electieve patiënten binnen vijf weken na de diagnose gestart zijn met de behandeling en 100% binnen zeven weken6. In de DSCA-analyses wordt de tijd aangehouden die verstrijkt tussen de datum van het eerste tumorpositieve biopt en de startdatum van de eerste behandeling, hetzij een operatie danwel neo-adjuvante therapie,Bij deze analyses wordt alleen gekeken naar patiënten die behandeld worden in een electieve setting en waar geen sprake is van een chirurgische ingreep (zoals het aanleggen van een stoma) voorafgaand aan de resectie.
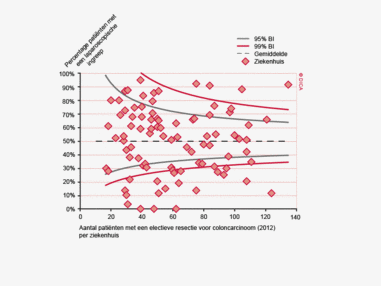
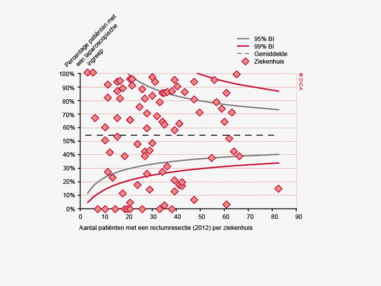
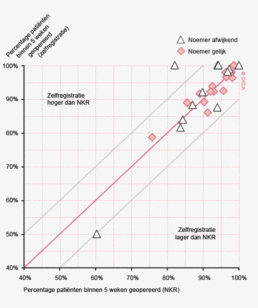
In 2012 hebben in totaal 5.393 patiënten een electieve colonresectie ondergaan zonder voorbehandeling. Hiervan wordt 69% binnen 5 weken geopereerd en 88% binnen zeven weken. De Treeknormen worden hier dus niet gehaald.
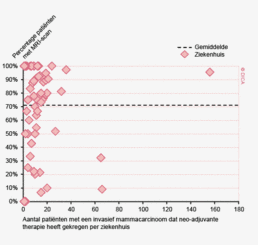
In 2012 zijn 2.436 patiënten electief geopereerd in verband met een rectumcarcinoom. Hiervan krijgt 77% een vorm van neo-adjuvante behandeling. Binnen de niet-voorbehandelde groep is 34% binnen 5 weken geopereerd en 60% binnen 7 weken. In de groep patiënten die preoperatieve therapie kregen, wordt hiermee bij 49% binnen 5 weken gestart, en bij 84% binnen 7 weken. Ook hier worden de Treeknormen dus niet gehaald.
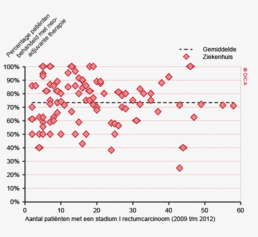
In de laatste jaren zijn de wachttijden echter wel verbeterd. Zo is in 2012 bij 84% van de patiënten met een rectumcarcinoom binnen 7 weken begonnen met preoperatieve behandeling, in 2009 betrof dit percentage nog 76%. Het percentage patiënten met een rectumcarcinoom dat binnen 7 weken enige vorm van therapie krijgt, is ook verbeterd: van 73% in 2009 naar 79% in 2012. Het type voorbehandeling heeft geen invloed op de wachttijd. Voor 88% van de patiënten met een coloncarcinoom vindt behandeling plaats binnen 7 weken (86% in 2009). Een langere wachttijd lijkt niet gerelateerd te zijn aan een hoger percentage spoedresecties.
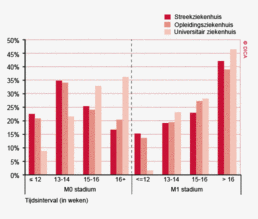
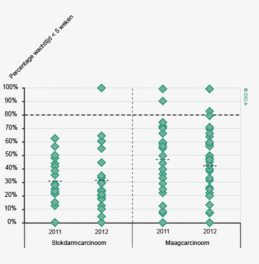
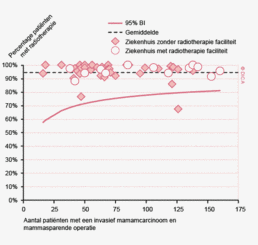
Wachttijden variëren aanzienlijk tussen ziekenhuizen. In figuur 1a/b ziet u het percentage patiënten per ziekenhuis dat volgens de Treeknormen binnen 7 weken behandeld wordt (exclusief patiënten met een chirurgische voorbehandeling). In deze figuren wordt de spreiding rondom het gemiddelde getoond en de daarbij horende betrouwbaarheidsintervallen.
Hoewel de hier gerapporteerde wachttijden een verbetering laten zien ten opzichte van voorgaande jaren wordt de Treeknorm voor zowel patiënten met een coloncarcinoom als die met een rectumcarcinoom niet gehaald. Dit kan meerdere redenen hebben. Logistieke redenen zoals de capaciteit van ziekenhuizen liggen voor de hand. Door toenemende concentratie in de zorg als gevolg van volumenormen nemen verwijzingen tussen ziekenhuizen toe en komen operatieprogramma’s in de verwijzingscentra onder toenemende druk te staan. De recent door de NVvH vastgestelde volumenorm voor rectumchirurgie zal dit effect mogelijk versterken. In specifieke gevallen kan bewust van de Treeknorm afgeweken zijn, bijvoorbeeld vanwege de voorkeur van een patiënt, een second opinion, een verwijzing naar een ander ziekenhuis of wanneer een bijkomende ziekte eerst behandeling behoeft7. Het bij toeval ontdekken van het coloncarcinoom bij een patiënt die voor een myocardinfarct op basis van anemie wordt opgenomen kan bijvoorbeeld een goede reden zijn om een operatie uit te stellen, om daarmee het operatierisico te verminderen. Desalniettemin is het een gezamenlijke verantwoordelijkheid van de beroepsgroepen, ziekenhuizen en zorgverzekeraars om er voor te zorgen dat concentratie van zorg niet leidt tot onacceptabel lange wachttijden.
Spoedoperaties
Idealiter worden patiënten met een colorectaal carcinoom in een electieve setting behandeld, omdat dit een kwalitatief beter voortraject oplevert en omdat een urgente operatie gepaard gaat met een aanzienlijk verhoogde morbiditeit en mortaliteit. Ook de kans op een eindstandig stoma neemt toe wanneer de ingreep met spoed moet worden uitgevoerd. Bij spoedresecties wordt bij 33% van de patiënten een eindstandig stoma aangelegd, terwijl dit bij electieve resecties 6% is.
Resecties in verband met een coloncarcinoom vinden vaker plaats in een urgente dan wel acute setting, dan resecties in verband met een rectumcarcinoom, respectievelijk bij 19% en 1,9% van de patiënten. Urgente of spoedresecties bij patiënten met een coloncarcinoom worden vaak uitgevoerd omdat de tumor aanleiding heeft gegeven tot een darmobstructie of zelfs een perforatie. Vanwege het belang van de preoperatieve behandeling bij het rectumcarcinoom wordt er in acute situatie bij deze tumoren vaak gekozen voor het aanleggen van een tijdelijk stoma, waardoor de resectie kan worden uitgesteld en de voorbehandeling alsnog plaats kan vinden. De patiënten met een rectumcarcinoom krijgen dan ook vaker een ontlastend stoma aangelegd voorafgaand aan de resectie (7,5%). Voor patiënten met een coloncarcinoom betreft het percentage voorafgaand aan de resectie aangelegde stoma’s of geplaatste stents slechts 1,5%.
Acute resecties bij de oudere patiënten (>70 jaar) gaan gepaard met een hoge mortaliteit (7,3%), en het is dus de vraag of de indicatie voor een stoma of stent als overbrugging naar electieve chirurgie moet worden uitgebreid. Pereira c.s. deden een prospectieve analyse van patiënten met een linkszijdig coloncarcinoom die zich met een darmobstructie presenteerden8. Van deze patiënten kreeg 13% een stent, 7,7% een ontlastend stoma en onderging 79% een acute resectie. Dit behoeft nadere analyse in de komende jaren.
In september 2013 start het Bevolkingsonderzoek Darmkanker, waarbij stapsgewijs alle Nederlanders tussen de 55 en 75 jaar worden opgeroepen voor de screening. Het is aannemelijk dat door het bevolkingsonderzoek er in de komende jaren een verschuiving op zal treden naar lagere tumorstadia en er een daling komt van het percentage patiënten dat in een acute of urgente setting moet worden geopereerd.
Neo-adjuvante therapie
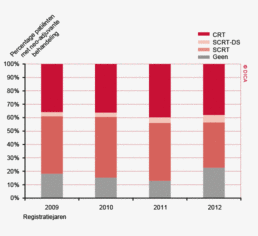
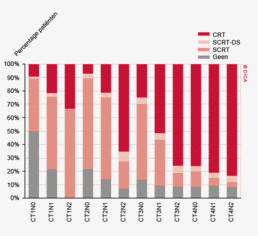
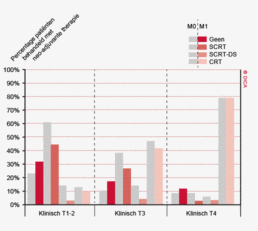
Een groot deel van de patiënten met een rectumcarcinoom ondergaat preoperatieve therapie. Er is echter een duidelijke kentering te zien. In 2011 was er nog een toename van het gebruik van neo-adjuvante therapie naar 86%. In 2012 zien we een daling naar 77%. Van de totale groep patiënten met een rectumcarcinoom krijgt 34% een kort schema radiotherapie (5x5 Gray) met een resectie na 5 dagen (SCRT), 5,6 % het korte schema met uitgestelde chirurgie (SCRT-DS) en 38% chemoradiotherapie of langdurig radiotherapie (CRT). Zie het hoofdstuk “Neo-adjuvante therapie” voor een uitgebreide beschrijving van de toepassing en de resultaten van neo-adjuvante behandeling.
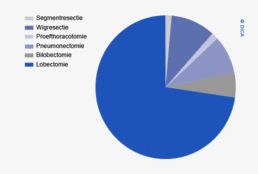
Chirurgie
Darmnaden en stoma’s
Beslissingen over het wel of niet aanleggen van een primaire darmnaad, en het hierbij aanleggen van een beschermend stoma worden bij patiënten met een coloncarcinoom voornamelijk genomen op basis van de mate van ileus, de conditie van de darmwand en patiëntkarakteristieken zoals leeftijd en comorbiditeit. Het percentage patiënten waarbij een primaire naad zonder ontlastend stoma is aangelegd neemt af met 3% (van 87% in 2009 tot 84% in 2012). Het aantal aangelegde darmnaden met een ontlastend stoma blijft met 4% de laatste jaren gelijk. In vergelijking met 2009 is het aantal eindstandige stoma’s met 2,5% toegenomen.
Bij patiënten met een rectumtumor is er de laatste jaren meer verandering zichtbaar in het type darmnaad dat aangelegd wordt. Er is een afname van 2% in de aanleg van een primaire darmnaad zonder beschermend stoma, een toename van 8% in de aanleg van een darmnaad met een beschermend stoma en een afname van 6% in de aanleg van een eindstandig stoma. Deze percentages zijn berekend voor de groep patiënten met een rectumcarcinoom die geen APR ondergingen.
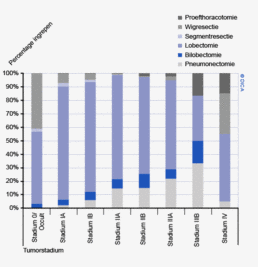
Laparoscopische resecties
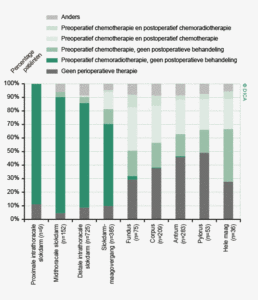
- Laparoscopische colonresecties zijn geassocieerd met kortetermijnvoordelen zoals een sneller herstel9,10. De afgelopen jaren is er een enorme toename te zien in het aantal laparoscopische resecties bij een gelijk blijvend percentage conversies.In de huidige richtlijn wordt bij het rectumcarcinoom nog geadviseerd om deze benadering enkel toe te passen in een gecontroleerde setting (onderzoeksverband), maar wordt in de gereviseerde richtlijn die dit jaar verschijnt naar alle waarschijnlijkheid aanbevolen als alternatief voor de open techniek, bij een goede patiëntselectie en aanwezige expertise2.
- Laparoscopische resecties worden bij het rectumcarcinoom vaker uitgevoerd dan bij het coloncarcinoom. Wanneer men echter alleen naar electieve resecties kijkt, verdwijnt dit verschil (55% laparoscopische colonresecties). In figuur 2a en b wordt de spreiding in Nederland in het toepassen van laparoscopische colorectale chirurgie weergegeven. Hierbij zijn de resecties waarbij in een vroeg stadium (binnen 30 minuten na aanvang van de operatie) geconverteerd is van een laparoscopische naar een open techniek, bij de open resecties ingedeeld.
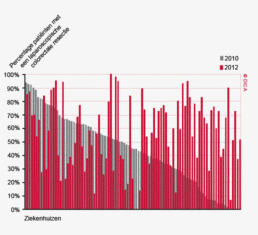
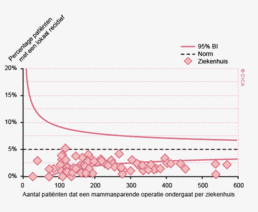
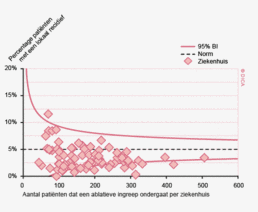
In figuur 3 wordt het verschil tussen 2010 en 2012 getoond in het toepassen van laparoscopische chirurgie voor het colorectaal carcinoom per ziekenhuis. Er zijn 43 ziekenhuizen die hetzelfde (-10% tot +10%) percentage patiënten laparoscopisch opereren, 6 ziekenhuizen die minder (-10% of meer) en 41 ziekenhuizen die meer (+10% of meer) laparoscopische ingrepen hebben gedaan. Internationaal gezien scoort Nederland hoog in de toepassing en kwaliteit van de laparoscopische colorectale chirurgie. De resultaten van de laparoscopische chirurgie in de DSCA zijn wetenschappelijk gepubliceerd in het chirurgische tijdschrift dat internationaal de hoogste impactfactor heeft, de ‘Annals of Surgery’11.
Transanale Endoscopische Microchirurgie
In 2012 zijn in totaal 153 transanale endoscopische resecties (TEM’s) in de DSCA geregistreerd. Hiervan ondergaan 12 patiënten in een later stadium alsnog een rectumresectie, een Low Anterior Resectie of een Abdomino-Perineale Resectie. Van de patiënten in de DSCA die initieel een TEM ondergaan heeft 39% een cT1-tumor, de overige patiënten een hoger stadium of een onbekend tumorstadium (35% cT2; 9,7% cT3; 0,7% cT4; 15,3% onbekend). Van alle patiënten die een TEM ondergaan wordt 34% neo-adjuvant behandeld (SCRT: 3,9%; SCRT-DS: 6,5%; CRT: 23.5%). Uiteindelijk blijkt 28% van de patiënten een hoger pathologisch stadium te hebben, (y)pT2-3, waarbij echter slechts een deel van de patiënten een aanvullende TME-rectumresectie heeft ondergaan. De radicaliteit voor de initiële transanale procedure is 95% wanneer er geen aanvullende TME wordt verricht. Het percentage complicaties is 13%. Er zijn 6 patiënten aanvullend behandeld (3 radiotherapie, 3 chemotherapie), 4 hiervan ondergingen alleen een TEM en 2 een TEM aangevuld met een additionele TME.
Radicaliteit
Waar in 2009 48% van de patiënten met een rectumcarcinoom een bekende Circumferentiele Resectie Marge (CRM) had is dit inmiddels opgelopen tot 90%. Ook is onder de geregistreerde CRM’s het percentage dat tumorpositief is gedaald van 14 naar 8,0%. Dit is een zeer goed resultaat. Wanneer men naar laparoscopisch uitgevoerde rectumresecties kijkt, is dit percentage zelfs nog lager, namelijk 5,8%. Eventueel speelt selectiebias hier een rol, waarbij resecties met marges ‘at risk’ mogelijk vaker via een open procedure worden verricht. Het dalende percentage positieve CRM’s is echter een zeer positieve ontwikkeling en zou veroorzaakt kunnen worden door de verbeterde toepassing van preoperatieve MRI-scanning van het kleine bekken. Ook het feit dat patiënten steeds vaker preoperatief in een MDO worden besproken, waarbij het hele team de MRI bespreekt, kan deze gunstige ontwikkeling mogelijk verklaren.
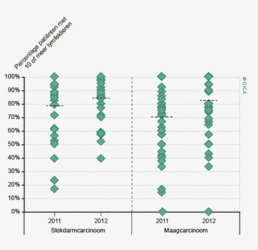
Lymfeklieren
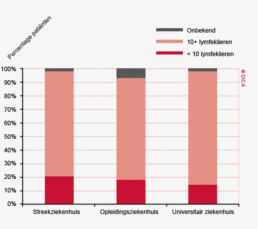
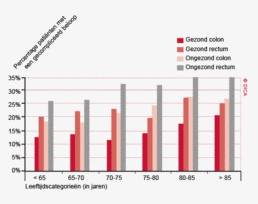
Het percentage patiënten met een colorectaal carcinoom waarbij ten minste tien lymfeklieren werden beoordeeld door de patholoog is ook toegenomen. Voor het coloncarcinoom is dit percentage gestegen van 73% in 2009 naar 89% in 2012. Bij het rectumcarcinoom is dit percentage verbeterd van 58 naar 75%. Het feit dat de DSCA door feedback naar de behandelteams heeft geleid tot een optimalisering van het zorgproces van patiënten met een colorectaal carcinoom, met bovendien aantoonbaar verbeterde uitkomsten van zorg, zal verder besproken worden in het hoofdstuk ‘Kwaliteitsindicatoren’.
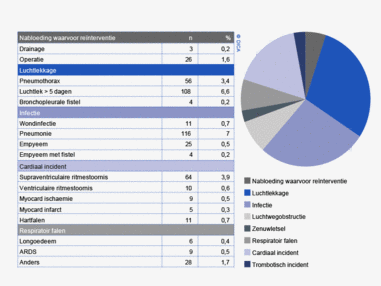
Complicaties
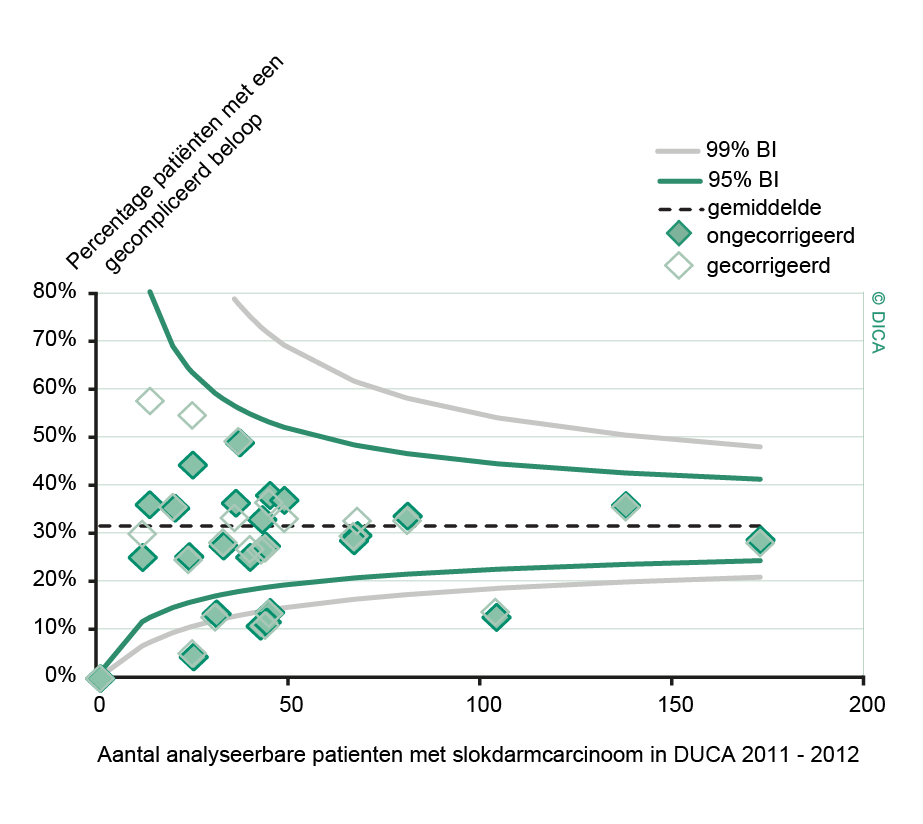
Sinds het starten van de DSCA-registratie is er een significante afname van ernstige postoperatieve complicaties bij resecties voor patiënten met een colon- of rectumcarcinoom. In de periode 2009-2012 daalde het percentage patiënten met een gecompliceerd beloop van 23% naar 18% bij patiënten met een coloncarcinoom en van 28% naar 22% bij patiënten met een rectumcarcinoom (tabel 4). Dit betekent een relatieve daling van respectievelijk 22 en 21%.
In 2012 bedraagt het percentage naadlekkages na een colonresectie, bij patiënten bij wie een darmnaad werd aangelegd, 6,5% en bleef zo gelijk ten opzichte van 2011. In vergelijking met 2009 is er wel een verbetering te zien, namelijk een daling van het percentage naadlekkages van 7,7 naar 6,6%. Voor rectumresecties is dit percentage in 2012 iets hoger dan bij colonresecties, maar ook hier is een duidelijke verbetering te zien ten opzichte van 2009; van 12% naar 8,0%.
| Colon | Rectum | |||||||
| Aantal | % | % | % | Aantal | % | % | % | |
| 2012 | 2012 | 2011 | 2010 | 2012 | 2012 | 2011 | 2010 | |
| Complicaties | ||||||||
| Peroperatief | 220 | 3,3% | 3,5% | nb | 158 | 5,7% | 4,5% | nb |
| Postoperatief < 30 dagen | 1976 | 29% | 31% | 33% | 995 | 36% | 38% | 41% |
| Algemene complicaties | 1231 | 18% | 18% | nb | 576 | 21% | 19% | nb |
| Chirurgische complicatie | 1220 | 18% | 17% | nb | 636 | 23% | 21% | nb |
| Gecompliceerd beloop | 1237 | 18% | 20% | 23% | 627 | 22% | 24% | 28% |
| Reinterventie | 751 | 11% | 11% | 15% | 383 | 14% | 14% | 18% |
| Relaparotomie | 45 | 0,7% | 0,4% | 0,5% | 33 | 1,2% | 1,2% | 0,9% |
| Relaparoscopie | 593 | 8,8% | 9,0% | 11% | 215 | 7,7% | 9,2% | 8,9% |
| Complicatie waarvoor reinterventie | ||||||||
| Naadlekkage/abces* | 375 | 6,5% | 6,5% | 8,0% | 106 | 8,0% | 9,2% | 12% |
| Abces elders | 22 | 0,3% | 0,4% | 0,5% | 41 | 1,5% | 2,0% | 2,7% |
| Nabloeding | 41 | 0,6% | 0,5% | 0,8% | 19 | 0,7% | 0,7% | 1,1% |
| Ileus | 58 | 0,9% | 0,9% | 1,3% | 51 | 1,8% | 1,9% | 2,6% |
| Fascie dehiscentie w.o.platzbauch | 89 | 1,3% | 1,1% | 2,1% | 33 | 1,2% | 1,0% | 1,6% |
| Overig | 129 | 1,9% | 2,3% | 3,2% | 105 | 3,7% | 4,2% | 4,1% |
| Mortaliteit | ||||||||
| 30 dagen mortaliteit | 217 | 3,2% | 3,4% | 4,1% | 42 | 1,5% | 2,2% | 1,9% |
| Ziekenhuismortaliteit | 233 | 3,5% | 3,6% | 4,4% | 47 | 1,7% | 2,4% | 2,2% |
| Radicaliteit | ||||||||
| R1/R2 resectie** | 205 | 3,0% | 4,2% | 3,1% | 224 | 8,0% | 8,9% | 9,1% |
| Missing CRM | 274 | 10% | 20% | 41% | ||||
| Positieve CRM*** | 197 | 8,0% | 8,4% | 12% | ||||
| Lymfeklieren | ||||||||
| 10 of meer | 5998 | 89% | 84% | 78% | 1991 | 75% | 68% | 61% |
| Adjuvante behandeling | ||||||||
| Radiotherapie | 41 | 0,6% | 0,6% | 0,3% | 20 | 0,7% | 1,6% | 0,6% |
| Chemotherapie | 2181 | 32% | 34% | 29% | 292 | 10% | 17% | 15% |
| HIPEC | 47 | 0,7% | 0,8% | 0,5% | 3 | 0,1% | 0,2% | 0,2% |
Mortaliteit
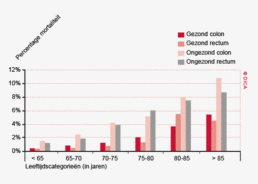
Sinds de introductie van de DCSA wordt een reductie van postoperatieve sterfte (ziekenhuis- en 30 dagen mortaliteit) gezien. Dit percentage is sinds 2009 voor het coloncarcinoom bijna met een derde gedaald, van 4,5 naar 3,2%. Voor het rectumcarcinoom is de mortaliteitsdaling nog groter, van 2,4% naar 1,5%. De relatieve risicoreductie voor zowel colon- als rectumcarcinoompatiënten is dus groot en resulteert bij benadering in een absolute daling van 109 sterfgevallen per jaar.
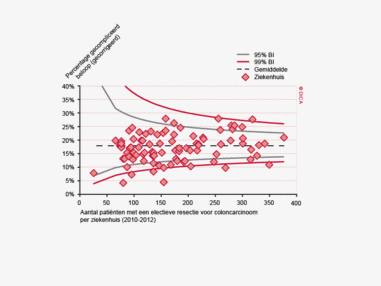
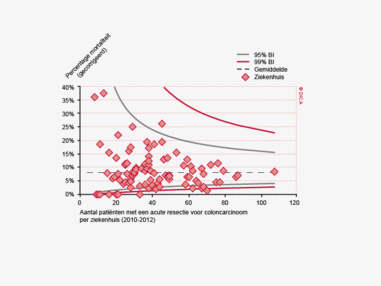
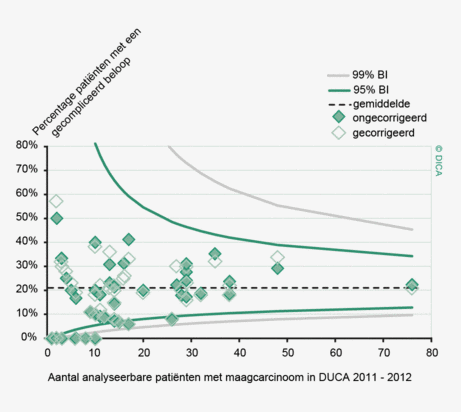
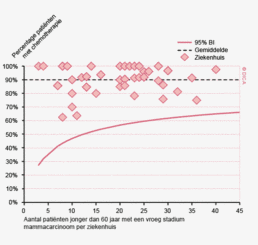
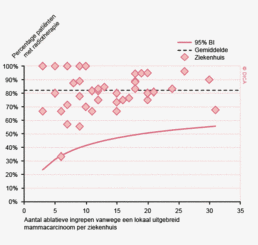
Dit jaar kon deze mortaliteitsdaling gevalideerd worden aan de hand van de gegevens uit de Nederlandse Kankerregistratie over het registratiejaar 2011. Zie voor deze verificatie het hoofdstuk 1 “Datacollectie en datacontrole”. In figuur 4a en b wordt middels een funnelplot de spreiding weergegeven in gecorrigeerde postoperatieve mortaliteit en het gecompliceerd postoperatief beloop na een colonresectie in een electieve setting. In figuur 5a en b wordt ditzelfde nogmaals getoond voor de patiënten die in een acute situatie geopereerd zijn.
Voor het rectumcarcinoom is de ziekenhuisvariatie kleiner. Wanneer men kijkt naar de gecorrigeerde mortaliteit na een rectumresectie zijn er geen ziekenhuizen die significant slechter presteren. Daarnaast zijn er minder ziekenhuizen waar het percentage patiënten met een gecompliceerd beloop na een resectie voor een rectumcarcinoom significant hoger is dan het gemiddelde, dit zijn drie ziekenhuizen.
Opnameduur
Door middel van ‘fast-track recovery’-programma’s proberen behandelteams het herstel van patiënten te bevorderen, waardoor deze minder lang in het ziekenhuis opgenomen hoeven te blijven. Een voorbeeld van zo’n programma is het ERAS-protocol, maar ondertussen bestaan er allerlei varianten van dergelijke zorgpaden. Een recent gepubliceerde studie, waarin het effect van de introductie van het ERAS-protocol in 33 Nederlandse ziekenhuizen is geëvalueerd, laat een vermindering van de opnameduur zien van gemiddeld 3 dagen12. Ook in de DSCA zien we deze daling in opnameduur terug. Voor colonresecties daalde de mediane opnameduur van 8 dagen in 2009 naar 7 dagen in 2012. Voor rectumresecties is de daling nog opmerkelijker: van 10 naar 8 dagen. De geconstateerde daling in het aantal complicaties kan hier zeker aan bijgedragen hebben. Ter vergelijking, in het rapport van de “national bowel cancer audit UK 2012” wordt een mediane opnameduur van 7 dagen voor het coloncarcinoom en 9 voor het rectumcarcinoom gevonden13.
De duur van de opname op de Intensive Care wordt sinds 2011 in de DSCA geregistreerd en is voor patiënten met een coloncarcinoom in 2012 gemiddeld 1,04 dagen [spreiding 0 tot 88 dagen] en met een rectumcarcinoom 0,75 dagen [spreiding 0 tot 122 dagen].In absolute aantallen gaat het om 9.138 dagen die colorectale patiënten op de Intensive Care verblijven. Een vermindering van het aantal ernstige complicaties na colorectale chirurgie zou dus ook tot een aanzienlijke vermindering van de IC-kosten kunnen leiden.
Aanvullende therapie
In 2012 heeft 77% van de patiënten met een rectumcarcinoom een vorm van preoperatieve behandeling gekregen, waarin het meest voor chemoradiotherapie (CRT) en korte radiotherapie (5x5 gray, SCRT) wordt gekozen. Dit wordt verder belicht in het hoofdstuk 7 ‘Neo-adjuvante therapie’.
In 2012 is 33% van de patiënten met een resectie van een coloncarcinoom met aanvullende chemotherapie behandeld. Conform de richtlijn betreft het voornamelijk patiënten met een stadium III, waarvan 68% aanvullende chemotherapie krijgt. Ook bij patiënten die een resectie ondergaan bij gemetastaseerde ziekte (stadium IV) is het percentage dat aanvullend behandeld wordt met chemotherapie hoog, namelijk 65%. Bij patiënten met een hoogrisico stadium II coloncarcinoom kan volgens de richtlijn ook chemotherapie overwogen worden. Er bestaat echter geen consensus over de definitie van het hoogrisico stadium II coloncarcinoom. Als risicofactoren worden T4, slechte differentiatiegraad, perforatie, obstructie bij presentatie, minder dan 10 regionale klieren onderzocht en angioinvasie van de tumor gehanteerd14,15. In de DSCA is in 2012 10% van de patiënten met een pathologisch stadium II met aanvullende chemotherapie behandeld. Van de patiënten bij wie minder dan 10 lymfklieren worden verwijderd krijgt 9,5% aanvullende chemotherapie bij (y)pT1, 15% bij (y)pT2 en 37% bij (y)pT3. Van de patiënten met (y)pT4 krijgt 55% aanvullende chemotherapie.
De landelijke richtlijn stelt dat oxaliplatin met 5-FU/leucovorin (FOLFOX) de standaard is voor zowel hoogrisico stadium II, als stadium III coloncarcinoom3.CAPOX (oxaliplatin met capecitabine) wordt beschreven als een goed alternatief. Sinds 2011 wordt in de DSCA het type chemotherapie geregistreerd. De meerderheid van de patiënten met een coloncarcinoom die aanvullend met chemotherapie worden behandeld, krijgt het CAPOX-schema (62%), een minderheid krijgt het FOLFOX schema (9%). Waarschijnlijk wordt om logistieke redenen afgeweken van de richtlijn. Zo heeft het CAPOX-schema een kortere behandelduur en is het volledig poliklinisch toepasbaar. Dit in tegenstelling tot het FOLFOX-schema dat gedurende 48 uur als continu infuus gegeven wordt.
Van de patiënten wordt 21% behandeld met Capecitabine monotherapie, een behandeling die er om bekend staat minder toxiciteit te geven. Ouderen met belangrijke comorbiditeit ervaren mogelijk een verhoogde toxiciteit en worden zodoende vaker met dit middel behandeld. Dit is ook terug te zien in de DSCA, waar de gemiddelde leeftijd in de CAPOX-groep 63 jaar is, en in de capecitabine-groep 72 jaar.
Voor het toepassen van aanvullende chemotherapie bij het rectumcarcinoom bestaat nog geen eenduidige conclusie3. In de DSCA wordt 11% van de patiënten met een rectumcarcinoom met aanvullende chemotherapie behandeld. Ook hier wordt het CAPOX-schema het meest toegepast (61%). Deze aanvullende therapie wordt vooral bij patiënten met de hogere tumorstadia gegeven; 82% van de patiënten die aanvullend met chemotherapie zijn behandeld heeft stadium III of IV rectumcarcinoom.
Referenties
1.Kwaliteitsindicatoren
Summary Samenvatting
- Sinds de start van de DSCA is de richtlijnnaleving op veel onderdelen van het zorgproces sterk toegenomen. Er is bovendien een sterke afname te zien van de variatie tussen ziekenhuizen, bijvoorbeeld in het aantal patiënten bij wie 10 of meer lymfeklieren werden onderzocht na een colonresectie. Ook de rapportage van circumferentiële resectiemarges (CRM’s), een belangrijke uitkomst van het pathologisch onderzoek bij rectumresecties, nam sterk toe.
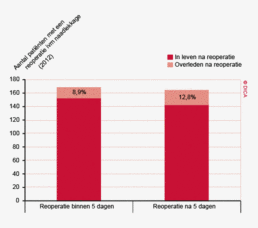
- De resultaten van de indicatoren betreffende het percentage uitgevoerde reïnterventies of heroperaties lijken zich te stabiliseren ten opzichte van 2011
- Een toenemend percentage patiënten met een rectumcarcinoom wordt geopereerd in een hoogvolume ziekenhuis. Dit is een direct effect van de recent door de Nederlandse Vereniging voor Heelkunde ingevoerde minimale volumenorm van 20 rectumresecties per jaar.
- De richtlijnnaleving verschilde in 2012 niet tussen ziekenhuizen met een hoog of laag volume aan rectumresecties. Wel blijkt het risico op een tumorpositieve CRM in ziekenhuizen met een hoog volume aan rectumresecties lager is dan in laagvolume ziekenhuizen. Hier gaat het nadrukkelijk om de analyse van de resultaten van groepen hoog- en laagvolume ziekenhuizen, wat niet betekent dat de resultaten in elk hoogvolume ziekenhuis beter zijn dan in elk individueel laagvolume ziekenhuis.
- Correcties voor casemix lijken slechts een beperkt effect te hebben op de verschillen tussen ziekenhuizen in het aantal onderzochte lymfeklieren na colonresecties. Een duidelijkere invloed van casemix wordt gevonden bij correcties van de indicatorresultaten betreffende tumorpositieve CRM’s bij rectumcarcinoomresecties. Het is goed voor te stellen dat deze uitkomst van rectumchirurgie sterk afhankelijk is van casemixfactoren zoals het tumorstadium en de afstand van de tumor tot de anus. Zo mogelijk zouden ziekenhuisverschillen op dit type kwaliteitsindicatoren dan ook voor casemix gecorrigeerd dienen te worden.
Richtlijnen
De landelijke richtlijnen1 vormen een belangrijke leidraad voor de behandeling van patiënten met een colorectaal carcinoom. Deze richtlijnen zijn ontwikkeld door specialisten uit meerdere (oncologische) vakgebieden, op basis van bewijsvoering uit de vakliteratuur aangevuld met kennis uit de praktijk. Verschillende aspecten van het behandelproces worden beschreven, zoals de diagnostiek, behandelingskeuze en begeleiding van de patiënt.
Een aantal van de in de richtlijn beschreven processen en kwaliteitsaspecten zijn door zorginstanties, die zich bezig houden met kwaliteit, geselecteerd als kwaliteitsindicator.
Kwaliteitsindicatoren
Een indicator wordt gedefinieerd als “een meetbaar aspect van de zorg dat een aanwijzing geeft over de kwaliteit van zorg.”2. Deze kwaliteitsindicatoren worden opgevraagd bij alle Nederlandse ziekenhuizen door twee instanties: de Inspectie voor de Gezondheidszorg (IGZ) en Zichtbare Zorg Ziekenhuizen (ZZZ).
De DSCA is zo opgezet dat deze gegevens over richtlijnnaleving en kwaliteitsindicatoren hierin worden geregistreerd. De online terugkoppeling biedt ziekenhuizen de mogelijkheid om de naleving van de richtlijnen binnen de eigen kliniek en in vergelijking met de andere Nederlandse ziekenhuizen te beoordelen (benchmarking). De DSCA levert de jaarlijkse gegevens voor de kwaliteitsindicatoren. Tabel 1 toont de kwaliteitsindicatoren die in de DSCA zijn opgenomen, waarbij staat aangegeven of deze door de IGZ of ZZZ worden uitgevraagd- of dat deze specifiek voor de DSCA is.
| Kwaliteitsindicatoren colorectaal carcinoom | |
| Diagnostiek | |
| ZZZ | Percentage patiënten, dat een electieve resectie ondergaat vanwege primair colorectaal carcinoom, bij wie preoperatief het gehele colon in beeld is gebracht |
| DSCA | Percentage patiënten met primair colorectaal carcinoom waarbij beeldvorming ter stadiëring van de lever én longen plaatsvond |
| DSCA | Percentage patiënten, dat een resectie ondergaat vanwege primair rectumcarcinoom, bij wie preoperatief een MRI van het bekken werd gemaakt. |
| IGZ/ZZZ | Percentage patiënten, dat een resectie ondergaat vanwege primair rectumcarcinoom, dat preoperatief in een multidisciplinair team wordt besproken |
| Voorbehandeling | |
| ZZZ | Percentage patiënten, dat een resectie ondergaat vanwege een cT3 of cT4 rectumcarcinoom, dat een vorm van preoperatieve radiotherapie heeft ondergaan. |
| Pathologie | |
| ZZZ | Percentage patiënten, dat een resectie ondergaat vanwege primair coloncarcinoom, bij wie 10 of meer lymfeklieren uit het resectiepreparaat zijn onderzocht |
| ZZZ | Percentage patiënten, dat een resectie ondergaat vanwege een primair rectumcarcinoom, bij wie de circumferentiele resectie marge (CRM) bekend is. |
| ZZZ | Percentage patiënten, dat een resectie ondergaat vanwege een primair rectumcarcinoom en bij wie de CRM bekend is, bij wie de CRM positief is |
| Nabehandeling | |
| ZZZ | Percentage patiënten, dat een resectie ondergaat vanwege een stadium III coloncarcinoom, dat met aanvullende chemotherapie wordt behandeld |
| a)Bij patiënten jonger dan 75 jaar | |
| b)Bij patiënten van 75 jaar of ouder | |
| Postoperatief beloop | |
| IGZ/ZZZ | Percentage patiënten, dat een resectie ondergaat vanwege primair colorectaal carcinoom, bij wie een (ongeplande) re-interventie is verricht |
| IGZ/ZZZ | Percentage patiënten, dat een resectie ondergaat vanwege primair colorectaal carcinoom, bij wie een reoperatie is verricht |
Processen
In voorgaande jaarrapporten van de DSCA viel al op dat na de start van de DSCA de gerapporteerde richtlijnnaleving op meerdere onderdelen toenam. Ook in 2012 nam, gemiddeld genomen, de compliantie met de richtlijnen toe.
Figuur 1 toont de landelijke resultaten voor de afgelopen drie jaar op de procesmaten en –indicatoren die in de DSCA worden geregistreerd. De reeds in 2011 opgemerkte sterke toename van het gerapporteerde percentage patiënten dat preoperatief beeldvorming van thorax en lever onderging ter stadiëring van de ziekte, nam in 2012 nog verder toe. Ook is het percentage patiënten met rectumcarcinoom bij wie voorafgaand aan de behandeling een MRI van het bekken werd gemaakt toegenomen tot meer dan 90%.
Het is goed om zich te realiseren dat het om het gerapporteerde percentage gaat en dat dit afhankelijk is van de volledigheid van de registratie of dit overeenkomt met het werkelijke percentage. Ondanks een al goede volledigheid op landelijk niveau in 2010 (>90% van landelijk te verwachten) en 2011 (94%) neemt deze volledigheid nog altijd ieder jaar iets toe. Dit kan ook van invloed zijn op verschillen in uitkomsten op de kwaliteitsindicatoren tussen de jaren.
Wanneer de volledigheid en betrouwbaarheid van de registratie hoog blijft, wordt de interpretatie van de gesignaleerde trends steeds betrouwbaarder.
Het percentage patiënten waarbij preoperatief het gehele colon in beeld is gebracht steeg iets minder, naar nu rond de 80%. Hierbij moet echter worden opgemerkt dat het volgens de richtlijn is toegestaan om binnen drie maanden na de operatie het nog niet in beeld gebrachte deel van het colon alsnog te visualiseren. Aangezien dit laatste niet in de DSCA-dataset is opgenomen, kunnen we nog niet volledig zien wat de compliance is van deze richtlijn. Het percentage was het hoogste bij patiënten bij wie de tumor in het rectum (82%) of caecum (92%) lag en het laagste bij patiënten met tumoren in de flexura lienalis (58%) en het colon descendens (62%).
Tenslotte valt op dat het aantal patiënten met een coloncarcinoom, waarbij 10 of meer lymfeklieren in het resectiepreparaat zijn onderzocht, met enkele procenten toenam. Ook het percentage patiënten met een rectumcarcinoom waarbij de CRM bekend was en door de patholoog gedocumenteerd was, is tot meer dan 90% is gestegen. Dit was in 2009 nog slechts 28% en in 2010 nog geen 60%. U vindt meer over de pathologische kwaliteitsparameters in hoofdstuk 4 “Pathologie”.
De toepassing van (neo)adjuvante therapie voor de diverse indicaties lijkt zich te stabiliseren.
Wachttijden
Een voor de patiënt belangrijke maat voor kwaliteit van zorg is de wachttijd tussen het moment van diagnose en de start van de behandeling. Over deze procesmaat wordt gerapporteerd in hoofdstuk 2 “Resultaten”.
Uitkomstindicatoren
In vergelijking met 2011 is het percentage reïnterventies en reoperaties gestabiliseerd (figuur 2). De norm lijkt zich rond de 12% respectievelijk 9% uit te kristalliseren. Het gevaar van een dergelijke indicator is dat men terughoudender zou kunnen worden om een reïnterventie te verrichten wanneer er verdenking op een chirurgische complicatie bestaat. Dit terwijl mogelijk juist laagdrempelig en vroegtijdig ingrijpen in een betere uitkomst van de complicatie kan resulteren (zie hoofdstuk 6 “Failure-to-rescue”). Deze perverse prikkel lijkt niet op te treden gezien het percentage gelijk blijft.
In voorgaande jaren was er bij een aanzienlijk percentage geregistreerde patiënten niet bekend wat de pathologische CRM-status was. Opmerkelijk is dat in 2012 bij een hoger percentage patiënten de CRM-status wel bekend was en dat dit gepaard ging met een betere uitkomst (minder vaak een positieve CRM bij de patiënten met een bekende CRM-status). Een positieve CRM is in de DSCA gedefinieerd als afstand van 1 mm of minder van de snijrand tot de tumor.
We kunnen bij deze uitkomstindicator als conclusie stellen dat er een betere datavergaring is ten opzichte van voorgaande jaren. Een uitspraak over een eventuele verbetering op deze uitkomst over de verschillende DSCA-jaren is moeilijker te doen gezien deze in voorgaande jaren nog erg onvolledig zijn aangeleverd. Wel illustratief is de vergelijking tussen de DSCA (2012) met de TME-trial (1996-1999)3: een verschil van 8% ten opzichte van 16% positieve CRM’s bij een gelijke definitie. Dit is een meer valide vergelijking omdat de registratie van de CRM in zowel de DSCA 2012 als de TME-trial een hoge volledigheid hadden.
In hoofdstuk 4 “Pathologie” wordt nader ingegaan op de CRM bij het rectumcarcinoom.
Structuurfactoren
Naast het monitoren van processen en uitkomsten zijn er op landelijk niveau normen gesteld op organisatorisch en structureel gebied. Hieraan moeten ziekenhuizen die oncologische zorg (willen) bieden voldoen. Recent werden deze normen benoemd in het normeringsdocument van de Stichting Oncologische Samenwerking (SONCOS)4, het nationale samenwerkingsverband tussen chirurgische, radiotherapeutische en medische oncologen. Hierin staan algemene voorwaarden voor oncologische zorg en specifieke kaders voor specifieke oncologische ziektebeelden waaronder ook het colorectaal carcinoom. Naast normen ten aanzien van de beschikbaarheid van onder andere endoscopische faciliteiten, (interventie)radiologie, (neo)adjuvante therapie en een multidisciplinaire behandeling, is deelname aan de DSCA een norm op zichzelf.
Volumenormen
Bovendien geldt een minimale volumenorm van 50 colorectale resecties per ziekenhuis per jaar, en voor de behandeling van het rectumcarcinoom 20 resecties per jaar.
De eerste (colorectale) volumenorm (50 colorectale resecties per ziekenhuis per jaar) is niet uit de DSCA te halen, omdat veel ziekenhuizen ook een aantal resecties per jaar verrichten in verband met benigne aandoeningen. De tweede volumenorm van 20 resecties voor het rectumcarcinoom per jaar is wel direct te herleiden uit de DSCA-dataset.
Hierbij moet worden opgemerkt dat clinici zelf registreren of de tumor in het rectum of in het colon ligt, waarbij verschillen in definitie van de anatomische begrenzingen van het rectum kunnen meespelen.
Uit de gegevens van de afgelopen jaren wordt duidelijk dat in toenemende mate aan de volumenorm wordt voldaan. Het percentage patiënten dat voor een rectumcarcinoom behandeld werd in een ziekenhuis dat 20 of meer resecties voor een rectumcarcinoom per jaar verrichtte, steeg van 80% in 2010, en 86% in 2011, naar 89% in 2012.
Er was in zowel de hoog- als laagvolume ziekenhuizen sprake van een vergelijkbare richtlijnnaleving (tabel 2) Echter, de belangrijkste kwaliteitsindicator, de CRM, was significant beter in de hoogvolume ziekenhuizen dan de laagvolume ziekenhuizen.”
Het verschil in het percentage positieve CRM tussen patiënten geopereerd in hoog- en laagvolume ziekenhuizen was 7,4% ten opzichte van 13% (p<0.01) in 2012.
Het gaat hier om de gepoolde data van alle instellingen. Uit deze vergelijking kunnen geen conclusies worden getrokken voor de individuele ziekenhuizen: er kunnen dus laagvolume ziekenhuizen zijn met vergelijkbare resultaten als in hoogvolume ziekenhuizen. Er zijn geen opvallende verschillen in tumorfactoren (T-stadium, afstand van de tumor tot de anus) tussen patiënten uit hoog- en laagvolume ziekenhuizen. Casemixcorrectie voor BMI, geslacht, T-stadium, voorbehandeling en afstand van de tumor tot de anus leidt overigens tot eveneens een significant verschil (OR 0,5; 95% CI 0.34-0.78) ten faveure van de patiënten geopereerd in een hoogvolume ziekenhuis. In hoogvolume ziekenhuizen werd in 2012 iets vaker preoperatieve chemoradiotherapie gegeven (38% ten opzichte van 32%), maar werden er ook iets vaker APR’s verricht (29% ten opzichte van 24%). Het percentage minimaal invasief geopereerde patiënten was 55% in de hoogvolume ziekenhuizen en 60% in de ziekenhuizen met een lager volume. Het is onduidelijk of dergelijke (relatief kleine) verschillen een deel van de verklaring voor de ogenschijnlijk betere uitkomsten zijn.
| 2012 | <20/jaar | 20+/jaar |
| aantal patiënten | 277 | 2390 |
| MRI verricht | 93% | 90% |
| preop MDO | 96% | 98% |
| voorbehandeling cT3/cT4 tumor | 84% | 84% |
| CRM gerapporteerd | 91% | 92% |
| positieve CRM | 13% | 7,4% |
Ziekenhuisverschillen
In het KWF Signaleringsrapport ‘Kwaliteit van kankerzorg in Nederland’5 was de grote variatie tussen ziekenhuizen voor wat betreft het behandelproces en de uitkomsten van zorg bij het colorectaal carcinoom een belangrijk punt van zorg.
Het eerder genoemde “benchmarken” van proces- en uitkomstindicatoren heeft als doel dat het gemiddelde verbetert, maar ook dat (ongewenste) spreiding vermindert. Figuur 3 illustreert dat deze spreiding vermindert: in bijna alle ziekenhuizen lag in 2012 het percentage patiënten bij wie 10 of meer lymfeklieren werden onderzocht tussen de 80 en 100%. In hoofdstuk 4 “Pathologie” wordt verder ingegaan op de interpretatie van deze bevinding.
Voor wat betreft de rapportage van de CRM bij rectumresecties was er in 2010 nog sprake van een enorme variatie en werd dit in een groot aantal ziekenhuizen bij minder dan de helft van de patiënten gerapporteerd. In 2012 lag dit percentage voor de meeste ziekenhuizen boven de 70-80%. Ook voor de procesmaten “preoperatief stadiëringsonderzoek thorax en lever” en “preoperatief het gehele colon afgebeeld bij electief geopereerde patiënten” is er een duidelijke afname in praktijkvariatie zichtbaar.
Casemixcorrectie
De indicatoren “10 of meer lymfeklieren” en “positieve CRM” geven inzicht in de kwaliteit van het pathologisch onderzoek en van de oncologische resectie. Echter, deze indicatoren zijn mogelijk ook afhankelijk van de casemix. Bij het verwijderen van een lang darmsegment wordt er meer mesenterium met daarin de lymfeklieren verwijderd6: bij een hemicolectomie rechts werd bij 91% van de patiënten 10 of meer lymfeklieren gevonden, terwijl dit 77% was bij een sigmoidresectie. Bij ziekenhuisvergelijkingen zou er mogelijk dus voor type segmentresectie gecorrigeerd moeten worden. Het is in te denken dat ook leeftijd en Body Mass Index (BMI) een rol spelen.
Een positieve CRM bij een resectie voor rectumcarcinoom kan afhankelijk zijn van het tumorstadium7, de afstand van de tumor tot de anus8 en mogelijk ook preoperatieve (chemo)radiotherapie.
In figuur 4a en 4b zijn ongecorrigeerde en gecorrigeerde percentages weergegeven van patiënten met 10 of meer klieren na een colonresectie en met een positieve CRM na rectumresectie. Bij de indicator “10 of meer lymfeklieren” (figuur 4a) lijkt er voor de ziekenhuizen weinig verschuiving op te treden na correctie voor casemix: bij 76 ziekenhuizen verschilt het gecorrigeerde percentage maximaal 1% van het ongecorrigeerde percentage. In figuur 4b zien we dat casemixcorrectie vaak juist een relatief grote invloed heeft op de uitkomst “positieve CRM” per ziekenhuis: hier zijn de afstanden tussen de open en dichte ruitjes gemiddeld veel groter en scheelt het voor veel ziekenhuizen 5 á 10%, tot maximaal 20% met de ongecorrigeerde getallen. Voor deze indicator lijkt casemixcorrectie dus wel essentieel in het kader van ziekenhuisvergelijkingen.
Referenties:
1. 2.Pathologie
Summary Samenvatting
- De pathologische verslaglegging vormt een belangrijk onderdeel van de behandeling van patiënten met een colorectaal carcinoom. Niet alleen geeft het pathologieverslag informatie over de prognose van de patiënt, maar ook heeft het consequenties voor de verdere (adjuvante) behandeling. De volledigheid en kwaliteit van het verslag is daarom de afgelopen jaren een belangrijk onderwerp geweest in de DSCA.
- De afgelopen jaren is er vooral aandacht geweest voor een kwaliteitsverbetering van (de verslaglegging van) het aantal te onderzoeken lymfeklieren bij een coloncarcinoom en de Circumferentiële Resectie Marge (CRM) bij een rectumcarcinoom. Voor beide onderdelen zijn zowel de verslaglegging als de uitkomsten fors verbeterd. Mogelijk heeft ook het gebruik van een gestandaardiseerd pathologieverslag aan deze ontwikkeling bijgedragen.
- Er is jaarlijks een gestage stijging van het aantal onderzochte lymfeklieren per patiënt te zien en een toename van het percentage patiënten bij wie 10 of meer lymfeklieren zijn onderzocht. Tevens zien we hierbij een afname van de variatie tussen ziekenhuizen.
- Ook heeft de aandacht in de literatuur, richtlijnen en clinical auditing voor de CRM als belangrijke prognostische factor voor het optreden van een lokaal recidief, haar vruchten afgeworpen. Sinds de start van de DSCA is de verslaglegging van de CRM van 50% naar 90% toegenomen en het aantal patiënten met een positieve CRM is gedaald van 14% naar 8%. Daarmee is een substantiële kwaliteitsverbetering in de zorg voor de patiënt met een rectumcarcinoom gerealiseerd. Aangezien er in de afgelopen drie jaar geen nieuwe behandelingsvormen zijn ontwikkeld, mag voorzichtig geconcludeerd worden dat juist de aandacht voor deze parameter tot een betere uitkomst heeft geleid.
- De komende jaren zal het focus verlegd worden naar de rapportage van extramurale veneuze invasie in de verslaglegging van alle gereseceerde colorectale tumoren.
Inleiding
De landelijke CBO-richtlijn coloncarcinoom uit 2008 vormt een belangrijke leidraad voor de behandeling van patiënten met een colorectaal carcinoom en bevat een apart hoofdstuk met aanbevelingen ten aanzien van het pathologisch onderzoek na colorectale resecties1. Na het verschijnen van deze richtlijn hebben de Inspectie voor de Gezondheidszorg (IGZ) en Zichtbare Zorg Ziekenhuizen (ZZZ) een aantal indicatoren vastgesteld voor de kwaliteit van het pathologisch onderzoek na colorectale chirurgie. Sinds het begin van de DSCA in 2009 worden drie kwaliteitsindicatoren geregistreerd: 1) meer dan 10 onderzochte lymfeklieren 2) rapportage van de (CRM) in het pathologieverslag bij rectum carcinoom 3) aanwezigheid van positieve CRM bij rectumcarcinoom. Daarnaast wordt in de DSCA de rapportage van extramurale veneuze invasie als procesindicator geregistreerd, hoewel deze in de CBO-richtlijn optioneel wordt genoemd.
Lymfeklieren
Het percentage patiënten waarvan door de patholoog in het resectiepreparaat tien of meer lymfeklieren rondom de tumor zijn onderzocht is een indicator voor de kwaliteit van zowel de chirurgische resectie als het pathologisch onderzoek. Het onderzoeken van voldoende lymfeklieren heeft als doel het opsporen van lymfekliermetastasen, die consequenties kunnen hebben voor een eventuele adjuvante therapie2.
In figuur 3 uit het hoofdstuk kwaliteitsindicatoren, worden verschillen in resultaten tussen ziekenhuizen op deze indicator weergegeven. Voor aanvang van de DSCA werd in de meeste ziekenhuizen bij minder dan 60% van de patiënten tien of meer lymfeklieren beoordeeld. In 2011 lag het gemiddelde percentage op 83% en in 2012 op 89%. Niet alleen is jaarlijks het gemiddelde percentage gestegen, maar bovendien is de spreiding tussen de ziekenhuizen sterk afgenomen. Het percentage varieert in 2012 op ziekenhuisniveau van 60 tot 98%. Er is dus opnieuw een duidelijke toename van het aantal adequaat gestadiëerde patiënten gerealiseerd in 2012 en er zijn steeds minder ziekenhuizen die achterblijven op deze kwaliteitsindicator. Het aantal best practices (>90% adequaat onderzochte preparaten in een ziekenhuis) is bovendien gestegen van 2 ziekenhuizen in 2009 tot 22 in 2012.
Bij analyse van de invloed van het type ziekenhuis - onderverdeeld in universitair centrum, opleidingsziekenhuis en streekziekenhuis - op de uitkomsten van deze indicator, worden er geen significante verschillen gevonden. Figuur 1 laat zien dat er in de universitaire centra weliswaar vaker tien of meer lymfeklieren beschreven worden in het PA-verslag, maar deze verschillen zijn niet statistisch significant. Ook wordt geen verschil gezien tussen ziekenhuizen met of zonder een opleiding voor chirurgen en pathologen.
Ook is gekeken naar verschillen in het aantal onderzochte lymfeklieren bij een laparoscopisch en een open uitgevoerde resectie. Aangezien de resectievlakken bij beide benaderingen gelijk zijn, zou men geen verschil in het aantal onderzochte lymfeklieren verwachten en dit was ook niet het geval in onze analyses. Zowel bij open als laparoscopische resecties worden er in meer dan 80% van de operaties minstens 10 lymfeklieren onderzocht en beschreven in het PA-verslag.
Concluderend kan gesteld worden dat er de afgelopen jaren flinke vooruitgang is geboekt op de indicator “percentage patiënten waarbij 10 of meer lymfeklieren zijn onderzocht”. Met het afnemen van de variatie tussen ziekenhuizen en de waargenomen verbetering in naleving van de richtlijn, is er op dit onderdeel van het pathologisch onderzoek een belangrijke kwaliteitsslag gemaakt. In de toekomst zal verder wetenschappelijk onderzoek het optimale aantal te onderzoeken lymfeklieren moeten vast stellen. Zo ook de relatie tussen het aantal onderzochte lymfeklieren en gevonden lymfekliermetastasen om de prognose voor de individuele patiënt nader te bepalen.
Circumferentiële resectiemarge
Het bereiken van een tumorvrije circumferentiële resectiemarge (CRM) bij de resectie van een rectumcarcinoom is van belang voor het voorkomen van een lokaal recidief. Met een tumorvrije CRM wordt een afstand van 1 mm of meer van de tumor tot de mesorectale fascie bedoeld. Een CRM van 1 mm of minder wordt als irradicaal (positief) beschouwd. Er is een sterke relatie tussen een positieve CRM, een matige kwaliteit van de uitgevoerde TME-techniek, het optreden van een lokaal recidief en een slechtere vijfjaarsoverleving3 4 5 6 7.
De vermelding van de kwaliteit van de mesorectale fascie en de CRM in het pathologieverslag vormt daarom een belangrijke feedback over de kwaliteit van de rectumchirurgie en de prognose van de patiënt. Daarmee speelt de patholoog een belangrijke rol in de kwaliteitscontrole van rectumchirurgie.
In voorgaande jaarrapportages werd aanvankelijk slechts in 50% van de pathologieverslagen een uitspraak gevonden over de CRM. Sinds de start van de DSCA is de registratie van deze parameter jaarlijks sterk toegenomen. In 2012 is de CRM in gemiddeld bij 90% van alle patiënten met een rectumcarcinoom bekend, zoals blijkt uit figuur 3 in het hoofdstuk kwaliteitsindicatoren. In vrijwel alle ziekenhuizen, ook die met lagere volumes aan rectumchirurgie, wordt tegenwoordig bij iedere patiënt met een rectumcarcinoom de CRM beschreven door de patholoog. Het is bijzonder te noemen dat in slechts drie jaar tijd deze kwaliteitsslag in de rapportage van pathologisch onderzoek bereikt is.
Tevens is het aantal patiënten met een positieve CRM de laatste jaren gestaag gedaald tot 8% in 2012 tegenover 14% in 2009 (tabel 1). Wanneer men de cijfers uit Nederland vergelijkt met de resultaten van de National Bowel Cancer Programme in Groot Brittannië (figuur 2), komen deze in grote lijnen met elkaar overeen 8. In Groot Brittannië wordt in 7,9% van de rectumresecties een positieve CRM gemeld, echter bij 40% van alle patiënten is de CRM niet bekend. In Nederland is de registratie de laatste jaren aanzienlijk verbeterd en ontbreekt de CRM nog slechts in 9,8% van de patiënten met een rectumcarcinoom.
| Positief* | Negatief* | Onbekend | Totaal | ||||
| Operatiejaar | n | % | n | % | n | % | n |
| 2009 | 137 | 14% | 844 | 86% | 1054 | 52% | 2035 |
| 2010 | 175 | 12% | 1296 | 88% | 1013 | 41% | 2484 |
| 2011 | 169 | 8,5% | 1814 | 91% | 511 | 21% | 2494 |
| 2012 | 195 | 8,0% | 2252 | 92% | 218 | 8,1% | 2665 |
Wanneer men kijkt naar de histologische kenmerken van irradicaal gereseceerde rectumcarcinomen, valt op dat bij patiënten met een mucineus carcinoom (n=73) of een zegelringtumor (n=37) vaker een positieve CRM gevonden wordt. In 2012 werd bij 6,6% van de adenocarcinomen (n=2.320) een irradicale CRM gevonden tegenover 14% bij patiënten met een mucineus carcinoom. Dit komt overeen met de literatuur waarin al jaren beschreven wordt dat mucineuze rectumtumoren slechter zichtbaar en te stadiëren zijn op de preoperatieve MRI, vaker een slechtere respons vertonen op neo-adjuvante therapie, een grotere kans hebben op een positieve CRM en geassocieerd zijn met een slechtere prognose.
Tabel 2 toont dat het percentage patiënten met een positieve CRM dat niet in een preoperatief multidisciplinair overleg is besproken, de laatste jaren verder is afgenomen. Dit suggereert dat er vaker een radicale resectie bereikt wordt, doordat de therapiekeuze in een multidisciplinaire setting geschiedt. Ook deze kwaliteitsindicator van Zichtbare Zorg heeft dus een kwaliteitsverbetering opgeleverd in de laatste jaren.
| Besproken in MDO in totale groep | Besproken in MDO bij CRM+ | |||
| Operatiejaar | n | % | n | % |
| 2009 | 1625 | 81% | 111 | 81% |
| 2010 | 2249 | 92% | 161 | 93% |
| 2011 | 2400 | 96% | 163 | 96% |
| 2012 | 2610 | 98% | 190 | 97% |
Concluderend kan gezegd worden dat de aandacht die het belang van een negatieve CRM gekregen heeft in de literatuur, richtlijnen en clinical auditing haar vruchten afwerpt. In 3 jaar tijd is het percentage patiënten met een irradicaal gereseceerd rectumcarcinoom gedaald van 14% naar 8%. Daarmee is een enorme kwaliteitsverbetering gerealiseerd, vooral als men zich realiseert dat de overleving van patiënten met een rectumcarcinoom is toegenomen en een lokaal recidief een ernstig probleem is met aanzienlijke morbiditeit. Er zijn weinig interventies binnen de oncologie die een dergelijke verbetering van uitkomsten voor kankerpatiënten hebben laten zien.
Distaal en proximaal snijvlak
In de DSCA is de afstand van de tumor tot het distale of proximale resectievlak als uitkomst geregistreerd zowel voor patiënten met een coloncarcinoom als rectumcarcinoom. Er is hierbij echter geen verschil gemaakt tussen het proximale en distale resectievlak. Hierdoor zijn de data onbetrouwbaar en niet geschikt voor analyse. In de literatuur is er geen relatie bekend tussen de precieze resectiemarges en de prognose bij patiënten met een coloncarcinoom, zolang de resectievlakken vrij zijn van tumorcellen. Om deze reden is de resectiemarge als parameter verwijderd uit de DSCA-dataset.
Voor patiënten met een rectumtumor geldt een ander adagium. Aangezien er wel voldoende bewijs is dat de distale resectiemarge bij deze tumoren van invloed is op de uitkomst voor de patiënt, zijn wij van mening dat deze parameter in het gestandaardiseerde pathologieverslag moet worden opgenomen9 10 11 12.Wellicht kan dan in de komende jaren inzichtelijk worden gemaakt wat de huidige distale resectiemarges voor rectumtumoren zijn in ons land en welke resultaten leiden tot de beste prognose voor de patiënt.
Pathologische tumorkenmerken
Het pathologisch onderzoek is van invloed op de keuze voor adjuvante behandeling van de individuele patiënt. Een voorbeeld hiervan is dat bij patiënten die geen lymfekliermetastasen maar wel ongunstige tumorfactoren hebben, zoals lymfangio-invasie en met name extramurale veneuze invasie, adjuvante chemotherapie overwogen dient te worden13 14 15 16 17.Dit is ook opgenomen in de Nederlandse richtlijn en relevant voor de dagelijkse praktijk.
Hoewel de DSCA in 2010 nog rapporteerde dat de extramurale veneuze invasie veelal niet of als onbekend geregistreerd was, is deze parameter in 2012 aanzienlijk beter geregistreerd, namelijk in 90% van de gevallen. Figuur 3 laat zien dat in 2012 bij 78% van de patiënten met een coloncarcinoom en bij 79% van de patiënten met een rectumcarcinoom geen extramurale veneuze invasie werd aangetoond. Opvallend hierbij is dat het aantal patiënten met extramurale veneuze invasie in de afgelopen twee jaren groter was voor het coloncarcinoom dan het rectumcarcinoom, te weten 17% ten opzichte van 10%.
Het is dan ook aan te bevelen om extramurale veneuze invasie in het ‘standaard pathologieverslag’ op te nemen. Door te streven naar een zo volledig mogelijk verslag van het pathologisch onderzoek wordt het in de toekomst nog beter mogelijk om therapie op maat te verzorgen voor individuele patiënten.
Referenties
1.Leeftijd en comorbiditeit
Summary Samenvatting
- Het colorectaal carcinoom komt voornamelijk voor op oudere leeftijd. Met de toenemende vergrijzing zal deze populatie en dus de incidentie bij ouderen van het colorectaal carcinoom stijgen.
- De fysiologie van de oudere patiënt is wezenlijk anders dan die van de jongere patiënt. Hoewel keuzes in behandeling van het colorectaal carcinoom hierop aangepast worden, is er nog altijd sprake van een hoge mortaliteit. Zodoende is het van belang dat deze groep patiënten beter in kaart gebracht wordt voor een adequate risico-inschatting en daarop aangepast behandelplan.
- Met het stijgen van de leeftijd neemt het percentage patiënten met comorbiditeit toe. Specifieke comorbiditeit vergroot niet alleen de kans op een complicatie van het betreffende orgaansysteem maar ook op een complicatie in de overige systemen. Daarnaast worden comorbiditeit en postoperatieve complicaties van grotere invloed met het toenemen van de leeftijd op het optreden van postoperatieve mortaliteit.
- In de huidige praktijk lijkt de chirurg bij het maken van een behandelplan zich nog vooral te laten leiden door leeftijd. Dit terwijl juist comorbiditeit de belangrijkste voorspellende factor is voor het postoperatieve beloop. Voor aankomend jaar ligt de uitdaging in het kwantificeren en het voor de clinicus hanteerbaar maken van de comorbiditeit als instrument voor de risico-inschatting. Er wordt toenemend gedacht dat ‘kwetsbaarheid’ (frailty) een centrale rol speelt bij het maken van een juiste risico-inschatting. Dit jaar zal er een pilot van start gaan die de frailty index als risicomaat gaat bekijken.
"Als alles goed functioneert, wat is er dan oud aan?"
- Wim T. Schippers
Kaderdefinities:
- De oudere patiënt: 80 jaar en ouder.
- De jongere patiënt: jonger dan 65 jaar.
- Gezond: (ASA-score=I/II) én (Charlsonscore 0).
- Ongezond: tenminste ASA-score III of Charlsonscore I.
-
ASA-classificatie:
score I: gezonde patiënt
score II: patiënt met milde systemische ziekte
score III: patiënt met ernstige systemische ziekte
score IV: instabiele patiënt
score V: moribund
- Charlsonscore: Een maat voor comorbiditeit. Aan iedere comorbiditeit wordt een gewogen score toegekend, gebaseerd op het relatieve risico op sterfte na 1 jaar.
- Complicatie: alle complicaties (zowel algemene als chirurgische) die binnen 30 dagen na de operatie ontstaan.
- Naadlekkage: lekkage van darmvocht of abcesvorming ter plaatse van de darmnaad waarvoor een heroperatie of een radiologische drainage is verricht.
- Reïnterventie: heroperatie binnen 30 dagen.
- Gecompliceerd beloop: een complicatie die gepaard gaat met verlengde opnameduur, reïnterventie of sterfte.
- Mortaliteit: Overlijden van de patiënt binnen 30 dagen na de operatie of tijdens dezelfde opname.
Inleiding
In Nederland is het colorectaal carcinoom bij mannen de derde en bij vrouwen de tweede meest voorkomende maligniteit. Ook in de Verenigde Staten zal chirurgie voor colorectaal carcinoom tot 2025 de grootste stijging laten zien in het aantal uitgevoerde operaties1. Daarnaast wordt door toenemende vergrijzing het aantal ouderen steeds groter en neemt zo de incidentie van het colorectaal carcinoom bij ouderen toe2.
In Nederland wordt het colorectaal carcinoom met name bij mensen boven de 60 jaar vastgesteld3. Het is goed zich te realiseren dat in een populatie met zo’n hoge gemiddelde leeftijd – het begrip ‘oudere patiënt’ in feite staat voor een ‘hoog-bejaarde’ medemens. Dit verschilt van het begrip ‘oudere’ in de Nederlandse samenleving, waar immers 65 jaar of ouder voor velen de grens voor de aanduiding ‘bejaard’ is. Wanneer in dit hoofdstuk dus wordt gesproken over ‘de oudere patiënt’ hebben we het over 80-plussers, ofwel hoogbejaarde mensen. De ‘jongere patiënt’ in dit hoofdstuk betreft patiënten van 65 jaar en jonger; ‘jonger’ is hier dus een relatief begrip.
Bij het interpreteren van de uitkomsten van chirurgie bij ouderen, spelen andere factoren een rol dan wanneer wordt gekeken naar uitkomsten van chirurgie voor de gehele populatie. Ten eerste is toenemende leeftijd op zichzelf al een risicofactor voor het ontwikkelen van perioperatieve complicaties en postoperatieve mortaliteit (figuur 1). Ten tweede neemt met de leeftijd ook de hoeveelheid bijkomende aandoeningen, de comorbiditeit, toe. Ten derde worden ouderen over het algemeen niet meegenomen in landelijke screeningsprogramma’s; ook bij het Bevolkingsonderzoek Darmkanker dat dit jaar van start gaat, is de bovengrens van de screening gesteld op 75 jaar. Ook in de huidige situatie hebben ouderen in het algemeen een verder gevorderd tumorstadium bij de operatie en ondergaan ze vaker spoedchirurgie vergeleken met jongeren4. Dit brengt extra risico’s met zich mee. Tenslotte worden uitkomsten van zorg bij ouderen beïnvloed door andere keuzes in de behandeling met betrekking tot het aanleggen van een eindstandig stoma of het al dan niet geven van (neo-) adjuvante therapie5,6.
Er zijn weinig studies bekend die bij oudere patiënten specifiek de relatie beschrijven tussen comorbiditeit en de performancestatus enerzijds en uitkomsten van chirurgie anderzijds. Deze data zijn echter wel nodig om de zorg voor deze patiënten te kunnen individualiseren. Gezien het verhoogde complicatie- en sterftepercentage is met een betrouwbare preoperatieve risico-inschatting, waarbij geanticipeerd kan worden op specifieke problemen, veel winst te behalen. Ook maatregelen in de perioperatieve bewaking van geselecteerde patiënten hebben een voorstelbaar gunstige invloed op de uitkomst van de zorg. Maar ook al in de preoperatieve fase kan een gedegen risico-inschatting helpen bij het maken van een behandelplan. Echter, gezien het ontbreken van wetenschappelijk bewezen scoringssystemen worden in de huidige praktijk vaak behandelkeuzen gemaakt op basis van beslisschema’s (algoritmen) die ontwikkeld zijn voor ‘de colorectale patiënt’ in algemene zin of op basis van de lokale voorkeuren van het chirurgisch-oncologisch team.
In dit hoofdstuk worden de behandelkeuzes en uitkomsten van colorectale chirurgie in verschillende leeftijdscategorieën beschreven. Per categorie wordt een onderscheid gemaakt tussen ‘gezonde’ en ‘ongezonde’ patiënten (zie kader voor definities). Er wordt per groep ingegaan op de behandelkeuzes die worden gemaakt met betrekking tot (neo-)adjuvante therapie, het wel of niet aanleggen van een stoma en op ongewenste uitkomsten zoals naadlekkage, re-interventies en mortaliteit.
Patiënten
Voor de analyses in dit hoofdstuk zijn de gegevens uit de DSCA van 2009 tot en met 2012 gebruikt. Van alle ruim 35.332 patiënten had ruim twee derde (72%) een coloncarcinoom en bijna een derde (28%) een rectumcarcinoom. Het merendeel van de patiënten met een colorectaal carcinoom is tussen de 60 en 80 jaar oud; van alle patiënten met een resectie voor een coloncarcinoom is 20% ouder dan 80 jaar; van de patiënten met een rectumcarcinoom is 11% ouder dan 80 jaar (figuur 2).
Comorbiditeit
Zoals bekend neemt met de leeftijd ook de comorbiditeit toe7. Boven de 80 jaar heeft meer dan de helft van de patiënten een Charlsonscore van 1 of hoger (60%) en heeft één op de drie patiënten een Charlsonscore van 2 of hoger (33%).
Wanneer gekeken wordt naar de ASA-classificatie, een scoringssysteem voor de fysieke conditie van de patiënt, worden dezelfde percentages gezien. Tot 70 jaar heeft 85% van de patiënten een relatief laag risico, een ASA-score van 1 of 2. Maar tussen de 70 en 80 jaar heeft bijna één op de drie patiënten een ASA-score van 3 of hoger en boven de 80 jaar is dit bijna één op de twee patiënten. Boven de 80 jaar heeft slechts 5% een ASA-score van 1.
De toenemende comorbiditeit bestaat uit een breed scala van aandoeningen.
Figuur 3 toont het voorkomen van verschillende type complicaties bij patiënten ouder dan 75 jaar met een specifiek type comorbiditeit. Uit deze figuur blijkt dat een specifiek soort comorbiditeit niet alleen de kans op een complicatie binnen het betreffende orgaansysteem vergroot, maar ook het risico op complicaties in de andere orgaansystemen doet toenemen. Zo is in de tabel te zien dat bij patiënten met neurologische comorbiditeit er niet alleen een verhoogd risico bestaat op neurologische complicaties, maar ook op pulmonale complicaties. De gevolgen van de neurologische aandoening, zoals slikproblematiek en verminderde hoestkracht, geven een hoger risico op longontstekingen.
Behandelkeuzes
In vergelijking tot jongeren, wordt er bij oudere patiënten, zowel bij het colon- als rectumcarcinoom, iets vaker gekozen voor een operatie via laparotomie, in plaats van een laparoscopische resectie. De keuze voor een primaire darmnaad na een colonresectie lijkt vooral te worden bepaald door de leeftijd. Naarmate de leeftijd hoger wordt, wordt iets vaker een eindstandig stoma aangelegd, terwijl ‘gezonde’ en ‘ongezonde’ patiënten ongeveer even vaak een eindstandig stoma krijgen (figuur 4). Bij rectumoperaties wordt er bij 51% van de ‘gezonde’ patiënten boven de 80 jaar een eindstandig stoma aangelegd versus 25% van de ‘ongezonde’ jongeren (tabel 2)
| colon | gezond <65 | ongezond < 65 | gezond 65-70 | ongezond 65-70 | gezond 70-75 | ongezond 70-75 | gezond 75-80 | ongezond 75-80 | gezond 80-85 | ongezond 80-85 | gezond 85+ | ongezond 85+ |
| Neo-adjuvante therapie | 8,9% | 7,2% | 7,5% | 6,5% | 6,4% | 5,7% | 4,8% | 3,3% | 6,1% | 3,9% | 3,9% | 2,6% |
| Benadering | ||||||||||||
| Open | 47% | 53% | 49% | 51% | 47% | 52% | 52% | 57% | 55% | 59% | 57% | 63% |
| Scopisch | 53% | 47% | 51% | 49% | 53% | 48% | 48% | 42% | 45% | 41% | 43% | 37% |
| Anastomose/stoma | ||||||||||||
| Primaire anastomose | 87% | 84% | 87% | 84% | 90% | 87% | 88% | 85% | 89% | 84% | 84% | 81% |
| Beschermend stoma | 4,5% | 4,5% | 4,9% | 4,1% | 4,6% | 4,1% | 4,6% | 3,9% | 2,6% | 3,4% | 2,8% | 2,6% |
| Eindstandig stoma | 8,1% | 11% | 8,2% | 12% | 5,8% | 9,1% | 7,6% | 11% | 8,8% | 13% | 14% | 17% |
| Uitkomsten | ||||||||||||
| Naadlekkage/abces | 6,6% | 8,6% | 6,4% | 7,0% | 4,7% | 7,3% | 5,0% | 8,1% | 5,7% | 7,3% | 5,9% | 5,8% |
| 30-dagen mortaliteit | 0,2% | 1,2% | 0,7% | 2,2% | 1,0% | 3,1% | 1,4% | 3,9% | 2,8% | 6,4% | 4,1% | 9,6% |
| Ziekenhuismortaliteit | 0,3% | 1,2% | 0,7% | 2,5% | 1,0% | 3,3% | 1,5% | 4,3% | 3,2% | 7,1% | 4,3% | 9,9% |
| Complicaties | 21% | 28% | 22% | 27% | 21% | 34% | 24% | 35% | 27% | 39% | 32% | 40% |
| Reïnterventie | 17% | 23% | 16% | 21% | 15% | 21% | 16% | 21% | 16% | 22% | 15% | 17% |
| Gecompliceerd beloop | 13% | 18% | 14% | 18% | 12% | 21% | 14% | 23% | 18% | 27% | 20% | 27% |
| rectum | gezond <65 | ongezond < 65 | gezond 65-70 | ongezond 65-70 | gezond 70-75 | ongezond 70-75 | gezond 75-80 | ongezond 75-80 | gezond 80-85 | ongezond 80-85 | gezond 85+ | ongezond 85+ |
| Neo-adjuvante therapie | 89% | 84% | 87% | 87% | 86% | 83% | 83% | 79% | 83% | 73% | 75% | 64% |
| Benadering | ||||||||||||
| Open | 55% | 57% | 53% | 57% | 55% | 58% | 52% | 59% | 52% | 55% | 66% | 58% |
| Scopisch | 44% | 42% | 44% | 41% | 44% | 41% | 46% | 39% | 46% | 44% | 33% | 37% |
| Transanaal | 1,3% | 1,0% | 2,1% | 1,8% | 1,7% | 1,4% | 2,0% | 1,9% | 1,5% | 1,1% | 1,6% | 4,2% |
| Anastomose/stoma* | ||||||||||||
| Primaire anastomose | 27% | 21% | 26% | 23% | 28% | 20% | 27% | 16% | 21% | 17% | 20% | 12% |
| Beschermend stoma | 57% | 54% | 53% | 50% | 49% | 45% | 43% | 35% | 28% | 23% | 17% | 15% |
| Eindstandig stoma | 16% | 25% | 21% | 27% | 24% | 34% | 30% | 49% | 51% | 61% | 63% | 73% |
| Uitkomsten | ||||||||||||
| Naadlekkage/abces | 11% | 13% | 9,8% | 8,8% | 9,3% | 9,9% | 7,4% | 9,4% | 7,0% | 7,1% | 3,2% | 9,1% |
| 30-dagen mortaliteit | 0,1% | 0,9% | 0,3% | 1,6% | 0,4% | 2,9% | 1,1% | 4,6% | 4,1% | 5,5% | 3,1% | 8,0% |
| Ziekenhuis mortaliteit | 0,2% | 0,9% | 0,4% | 1,6% | 0,6% | 3,6% | 1,1% | 5,4% | 4,5% | 6,6% | 3,1% | 8,0% |
| Complicatie | 33% | 39% | 36% | 40% | 35% | 44% | 32% | 45% | 37% | 48% | 42% | 45% |
| Reïnterventie | 22% | 24% | 21% | 25% | 19% | 28% | 17% | 26% | 19% | 26% | 8% | 19% |
| Gecompliceerd beloop | 20% | 26% | 22% | 26% | 23% | 32% | 19% | 32% | 27% | 35% | 24% | 35% |
Gecompliceerd beloop
Het is bekend dat het percentage majeure postoperatieve complicaties bij ouderen na electieve colorectale chirurgie hoog is; percentages tot 27% zijn gerapporteerd en in het geval van een spoedoperatie is dit risico nog hoger. De percentages gerapporteerd door de DSCA zijn in dezelfde orde van grootte; afhankelijk van de leeftijd en lokalisatie van de tumor varieert het percentage patiënten met een gecompliceerd beloop van 14% na colonchirurgie bij de ‘gezonde’ patiënt boven de 75 jaar, tot 35% na rectumchirurgie bij de ‘ongezonde’ patiënt boven de 85 jaar (tabel 1 en 2).
Tabel 1 en 2 tonen duidelijk het effect van comorbiditeit op het postoperatieve beloop: in elke leeftijdscategorie krijgen ‘ongezonde’ patiënten bij een operatie voor zowel het colon- als het rectumcarcinoom in elke leeftijdscategorie vaker complicaties. Ook ondergaan zij meer reïnterventies en overlijden zij vaker aan de gevolgen van de operatie.
Opvallend is de sterke stijging van mortaliteit bij toename van de leeftijd (figuur 1). Dit is mogelijk een gevolg van het effect van perioperatieve complicaties op mortaliteit; wellicht verlopen deze bij de oudere patiënten dramatischer dan bij de jongere. Maar ook is bekend dat de mortaliteit bij ouderen hoger is door andere perioperatieve doodsoorzaken dan direct chirurgiegerelateerd5. Figuur 5 en 6 geven het percentage patiënten met een gecompliceerd postoperatief beloop en de postoperatieve mortaliteit weer na een colon- en rectumoperatie, uitgesplitst naar ‘gezonde’ en ‘ongezonde’ patiënten. Hieruit blijkt dat leeftijd zeker niet de enige parameter is waarop het risico op postoperatieve sterfte ingeschat moet worden. Bijvoorbeeld, een ‘gezonde’ patiënt van 80 jaar heeft een lager risico op postoperatief overlijden dan een ‘ongezonde’ patiënt van vijf tot tien jaar jonger. Boven de 80 jaar bedraagt de mortaliteit na colonchirurgie 6,4% bij een ongezonde oudere patiënt en 2,8% bij gezonde ouderen. Deze percentages zijn respectievelijk 1,2 en 0,2% bij jongeren.
Het percentage naadlekkage bij ouderen is laag (3,2%) in vergelijking met het opvallend hoge percentage van 13% in de groep ‘ongezonde’ jongere patiënten. Wellicht laten we ons nog te veel leiden door leeftijd en te weinig door performancestatus en comorbiditeit. Als we kijken naar het type voorbehandeling bij het rectumcarcinoom, valt met name op dat oudere patiënten minder vaak voorbehandeld worden (tabel 2). Als ouderen wel neo-adjuvante behandeling krijgen, dan is dit in het algemeen kortdurende radiotherapie (5x5 gray). Bij jongere patiënten wordt vaker chemoradiotherapie toegepast. Naarmate de leeftijd en de comorbiditeit toenemen, wordt chemoradiotherapie minder vaak toegepast en krijgen patiënten vaker geen voorbehandeling. Ook hier zouden we idealiter de oudere patiënt die wel fit genoeg is voor (neo-) adjuvante therapie selecteren.
Verbeterpotentieel
De resultaten van de DSCA laten zien dat leeftijd een belangrijke rol speelt in de behandelkeuzes die we maken en het daarop volgende postoperatieve beloop. Een andere belangrijke constatering is dat leeftijd, als een op zich staand gegeven, maar ten dele verantwoordelijk is voor de hogere postoperatieve morbiditeit en mortaliteit bij ouderen. Het is dus terecht dat de kalenderleeftijd alléén geen doorslaggevende reden mag zijn in de keuze voor een primaire naad of een eindstandig stoma en misschien zelfs niet in het wel of niet geven van preoperatieve radiotherapie. De comorbiditeit van een patiënt en dus de mate van fitheid voor een operatie bepaalt mede hoe het verdere beloop zal zijn. Een vitale gezonde oudere patiënt heeft evenveel kans op complicaties als een jongere patiënt met veel comorbiditeit, en andersom. Ondanks een in de tabellen schijnbaar adequate risico-inschatting pre- en peroperatief (zoals meer stoma’s bij spoedpatiënten, bij hogere leeftijd en bij meer comorbiditeit) zijn er nog altijd veel complicaties en een hoge mortaliteit. De vraag die hierbij opkomt, is of de risicopatiënt wel adequaat geïdentificeerd wordt. Jongere ‘ongezonde’ patiënten hebben namelijk niet altijd betere uitkomsten dan oudere ‘gezonde’ patiënten. Worden ouderen dan niet te conservatief behandeld? De analyses in dit hoofdstuk geven geen antwoord op deze vraag, maar onderstrepen wel het belang van het identificeren van de ware risicopatiënt.
Kwetsbaarheid
Bij ouderen lijken comorbiditeit, beperkingen en kwetsbaarheid belangrijke factoren. De gegevens beschikbaar in de DSCA zijn op dit moment nog onvoldoende om de kwetsbaarheid op patiëntniveau te kunnen analyseren. Het registreren van een kwetsbaarheidsscore is dus wenselijk, maar dit betekent dat die ook in de dagelijkse klinische praktijk moet worden vastgelegd. Oudere patiënten die het eerste jaar overleven hebben dezelfde leeftijds-gecorrigeerde ziektevrije overleving, kwaliteit van leven en performancestatus als jongere patiënten. Dus meer geïndividualiseerde zorg in de vroege postoperatieve fase en in het eerste postoperatieve jaar kunnen helpen bij het verbeteren van de lange-termijn resultaten. Gegeven het nog altijd hoge percentage perioperatieve morbiditeit en mortaliteit bij ouderen geregistreerd in de DSCA lijkt met initiatieven als de ontwikkeling van een specifiek op ouderen gerichte risico-inventarisatie, of het installeren van multidisciplinaire ‘ouderenteams’, veel winst te behalen. Vanuit de Nederlandse Vereniging voor Heelkunde en de Nederlandse Vereniging voor Klinische Geriatrie zijn er daarom initiatieven gestart om te komen tot een multidisciplinaire verbetering van de zorg voor de kwetsbare colorectale patiënt.
Spoedoperaties in relatie tot leeftijd, comorbiditeit en uitkomst.
Spoedresecties worden vooral verricht bij patiënten met een coloncarcinoom, namelijk bij 19% van de patiënten versus 1% bij rectumcarcinoompatiënten. Daarom wordt niet separaat ingegaan op spoedresecties vanwege een rectumcarcinoom. Bij spoedpatiënten is er vaker sprake van een verder gevorderd stadium van de ziekte en is er geen plaats voor neo-adjuvante therapie. Tevens is de ASA-score van de patiënten hoger en ontstaan er ook meer postoperatieve complicaties. Het percentage spoedingrepen bij jongeren of ouderen, ongeacht de gezondheidstoestand, komt overeen en ligt rond de 20 tot 25%. In de groep patiënten van 70 tot 80 jaar ligt dit percentage lager, tussen de 15 en 20%. Per leeftijdscategorie vinden bij ‘ongezonde’ patiënten vaker spoedresecties plaats in vergelijking met ‘gezonde’ patiënten. Behalve bij patiënten boven de 80 jaar, bij hen vindt bij 19% van de ‘ongezonde’ patiënten een spoedresectie plaats tegenover 25% bij de ‘gezonde’ patiënten. De vraag is of er bij oudere patiënten vaker gekozen wordt om af te zien van een spoedresectie. De gegevens om deze vraag te beantwoorden zijn echter niet beschikbaar in de registratie van de DSCA.
Als we in de database kijken naar het verband tussen de ASA-classificatie van patiënten en het aantal uitgevoerde spoedresecties, dan zien we meer spoedresecties bij hogere ASA-scores. Hierbij moet men zich ervan bewust zijn dat er een causaal verband is: een ASA-classificatie van 4 of 5 kan het gevolg zijn van tumorcomplicaties, bijvoorbeeld een obstructie of perforatie. Spoedresecties gaan gepaard met een bijna driemaal hogere mortaliteit ten opzichte van electieve resecties (9,3% versus 3,5%). Een percentage dat bovendien lineair oploopt met de leeftijd. Een kwart van de spoedoperaties verloopt gecompliceerd, namelijk bij 26% van de patiënten versus 17% bij electief geopereerden. Tijdens een spoedresectie krijgt een derde van de patiënten een stoma. Meestal is dit een eindstandig stoma: 29 tegenover 5,5% bij electieve operaties.
Referenties
1.Failure-to-rescue na postoperatieve complicaties
Summary Samenvatting
- Er zijn slechts relatief kleine verschillen in complicaties tussen ziekenhuizen met hoge en lage mortaliteit; echter in ziekenhuizen met hogere mortaliteitsratios hebben patiënten met een gecompliceerd beloop een grotere kans om aan de complicatie te overlijden (failure to rescue; FTR) dan in de ziekenhuizen met een lage mortaliteit. Door middel van teruggekoppelde FTR-gegevens kunnen chirurgische teams de mate monitoren waarin complicaties worden opgespoord en behandeld en zo gericht de postoperatieve sterfte nog verder terugdringen.
- Patiënten met een coloncarcinoom krijgen minder vaak postoperatieve (ernstige) complicaties maar hebben een twee keer zo grote kans hieraan te overlijden dan patiënten met een rectumcarcinoom. Dit geldt ook wanneer alleen electieve resecties worden beoordeeld. Waarschijnlijk spelen hier verschillen een rol in patiëntfactoren, anatomie en ingreep, maar mogelijk ook het gespecialiseerde karakter dat rectumchirurgie in Nederland heeft ten opzichte van colonchirurgie.
- De typen complicaties die relatief vaak tot sterfte leiden zijn pulmonale en cardiale complicaties en darmnaadlekkages. De mortaliteit is relatief laag na geïsoleerde chirurgische complicaties. Een sterke toename in postoperatieve mortaliteit wordt voor zowel patiënten met een colon- als rectumcarcinoom gezien wanneer hier één of meerdere algemene complicaties bij komen. Echter, ook geïsoleerde algemene (niet-chirurgische) complicaties leiden vaak tot sterfte en 43-48% van de overleden patiënten had alléén algemene complicaties. Preventie, herkenning en behandeling van (bijkomende) niet-chirurgische complicaties kunnen mogelijk leiden tot een reductie in postoperatieve mortaliteit.
- Een reoperatie binnen 5 dagen na de eerste operatie lijkt te leiden tot een lagere mortaliteit secundair aan darmnaadlekkage. Het vroeg ontdekken en behandelen van complicaties kan mogelijk orgaandysfunctie, secundaire complicaties en overlijden voorkomen. Protocollaire postoperatieve monitoring van patiënten, de beschikbaarheid van Spoed Interventie Teams en de invulling van (weekend)diensten zijn hierbij mogelijk van invloed.
Colorectale resecties worden in vrijwel elk Nederlands ziekenhuis in een behoorlijk volume verricht, maar moeten desalniettemin beschouwd worden als hoogrisicochirurgie. Binnen de algemene chirurgie behoren colorectale operaties tot het type ingrepen met een aanzienlijke kans op morbiditeit en mortaliteit1 2. Om deze reden heeft het verminderen van ongewenste uitkomsten, zoals complicaties en postoperatieve sterfte veel aandacht in de chirurgische opleiding en dagelijkse chirurgische praktijk.
De Dutch Surgical Colorectal Audit (DSCA) heeft als doel om door middel van continue feedback behandelaars te stimuleren en te helpen complicaties en sterfte te verminderen. Dit hoofdstuk zal ingaan op complicaties na colorectale chirurgie en het proces waarin ernstige complicaties leiden tot postoperatieve mortaliteit. Door te analyseren welke factoren hierbij van invloed zijn, kan inzicht verkregen worden in de zorgprocessen die leiden tot betere uitkomsten van de zorg.
Failure-to-rescue
Het sterftepercentage onder patiënten bij wie een postoperatieve complicatie is opgetreden, failure-to-rescue (FTR), kan een belangrijke maat zijn voor het vergelijken van de kwaliteit van ziekenhuizen3. Een FTR-percentage van 33% procent wil zeggen dat één derde van de patiënten bij wie een postoperatieve complicatie is opgetreden, uiteindelijk komt te overlijden. Het weerspiegelt de mate waarin het team van behandelaars in staat is om een fataal beloop na een complicatie af te wenden. De achterliggende gedachte is dat ernstige complicaties, zoals darmnaadlekkage, nooit geheel te voorkomen zijn, maar dat door tijdige opsporing en adequate behandeling van deze complicaties de sterfte hieraan tot een minimum beperkt kan worden.
Er is toenemend bewijs dat ziekenhuizen met een hoge postoperatieve mortaliteit nauwelijks hogere complicatiepercentages hebben; maar dat in die ziekenhuizen de kans groter is dat een postoperatieve complicatie fataal verloopt. Deze ziekenhuizen hebben dus een hoog FTR-percentage4 5. Een grote Britse studie wees bijvoorbeeld uit dat ziekenhuizen met een hoge mortaliteit hetzelfde percentage complicaties hadden als ziekenhuizen met de laagste mortaliteit, maar dat het percentage patiënten dat hieraan kwam te overlijden groter was in de ziekenhuizen met hoge mortaliteit6.
In dit hoofdstuk is voor het vergelijken van ziekenhuizen FTR gedefinieerd als ‘het percentage ziekenhuismortaliteit binnen de groep patiënten met een gecompliceerd beloop na colorectale resectie’. Sinds 2009 is ‘gecompliceerd beloop’ een van de belangrijkste uitkomstmaten in de DSCA, die voor casemix gecorrigeerd wordt en teruggekoppeld wordt aan de ziekenhuizen. Gecompliceerd beloop is hierbij gedefinieerd als ‘een complicatie leidend tot een reïnterventie, tot sterfte of tot een opnameduur van meer dan 14 dagen’. De minst ernstige complicaties, die het postoperatieve beloop nauwelijks beïnvloeden, worden in deze definitie bewust buiten beschouwing gelaten. Dit om te voorkomen dat verschillen in FTR vooral gebaseerd zijn op de zorgvuldigheid waarmee ziekenhuizen die minder ernstige complicaties registreren. Echter, om een goed beeld te krijgen van de impact van diverse typen complicaties op de mortaliteit na colorectale chirurgie, wordt in de onderstaande paragrafen gekeken naar alle complicaties en niet alleen naar gecompliceerd beloop.
Ziekenhuisverschillen
Figuur 1 toont de verschillen tussen ziekenhuizen in voor casemix gecorrigeerde FTR in de periode 2010-2012. De spreiding is groot, variërend tussen 0 en 47%, waarbij de meeste ziekenhuizen FTR-percentages van ruwweg tussen de 10 en 30% hadden. In de best presterende ziekenhuizen hadden patiënten met een gecompliceerd beloop dus ongeveer 10% kans om te overlijden; terwijl deze kans ongeveer drie keer zo hoog was in de minder presterende ziekenhuizen. Acht ziekenhuizen presteerden beter dan gemiddeld met FTR-percentages gelegen onder de onderste 95% betrouwbaarheidslijn in de funnelplot. Deze ziekenhuizen hadden FTR-percentages van minder dan 10%. Vier ziekenhuizen hadden een hoger percentage FTR dan gemiddeld.
In figuur 2 zijn de ziekenhuizen ingedeeld in vijf gelijke groepen, op basis van hun voor casemix gecorrigeerde mortaliteitscijfers in de periode 2010 - 2012. De meest linker groep ziekenhuizen heeft het laagste percentage postoperatieve mortaliteit (gemiddeld 1,9%) en de meest rechter groep het hoogste percentage (gemiddeld 7,1% De postoperatieve mortaliteit verschilde derhalve een factor 3,7 tussen de groep met de laagste en de groep met de hoogste mortaliteit.
Per groep is aangegeven welk percentage patiënten postoperatieve complicaties had, welk percentage patiënten een gecompliceerd beloop had en bij welk percentage van de patiënten er sprake was van ‘failure to rescue’. De figuur toont dat het verschil in overall complicaties klein is tussen de ziekenhuizen met de hoogste en laagste mortaliteit: 29 t.o.v. 35%. Deze factor 1,2 is onvoldoende om het grote verschil in mortaliteit tussen de twee groepen te verklaren. Hetzelfde geldt voor de verschillen in gecompliceerd beloop: 19 en 26% (factor 1,36). De groepen ziekenhuizen met de hoogste en laagste mortaliteit karakteriseren zich dus met name door een groot verschil in FTR: 10% tegenover 27% (factor 2,7).
Deze bevindingen sluiten aan bij de resultaten van een groot onderzoek met patiënten die in het National Surgical Quality Improvement Program (NSQIP) van the American College of Surgeons werden geregistreerd. Het betrof patiënten die colorectale chirurgie, aneurysmachirurgie, perifere vaatchirurgie (bypass) of een beenamputatie ondergingen5. In deze studie was het complicatiepercentage in de ziekenhuizen met de laagste mortaliteit 25%, tegenover 27% in de ziekenhuizen met de hoogste mortaliteit. Het percentage ernstige complicaties toonde eveneens weinig variatie, van 16 tot 18%. Dit terwijl het verschil in FTR aanmerkelijk groter was, variërend van 12 tot 21% in de deelnemende ziekenhuizen. In de DSCA lijken de verschillen in complicaties tussen ziekenhuizen met hoge en lage mortaliteit evenwel iets groter, maar verschilt de FTR ook meer. Opvallend is dat ziekenhuizen met de hoogste mortaliteit iets minder complicaties registreerden dan de ziekenhuizen met een gemiddelde mortaliteit. Wel was het percentage patiënten met ernstige complicaties (gecompliceerd beloop) iets hoger in de ziekenhuizen met een hoge mortaliteit.
Er zijn in figuur 2 ruwweg drie typen ziekenhuis te onderscheiden:
- De best presterende ziekenhuizen, met zowel lage complicatiepercentages als een lage FTR, resulterend in de laagste postoperatieve mortaliteit (steeds de meest linker balk).
- De gemiddeld presterende ziekenhuizen – de middelste balk – met iets hogere percentages patiënten met complicaties en gecompliceerd beloop dan de best presterende ziekenhuizen, maar met gemiddelde mortaliteit, omdat de percentages FTR acceptabel zijn.
- De minst presterende ziekenhuizen: het percentage overall complicaties is in deze ziekenhuizen zelfs iets lager dan in de gemiddeld presterende ziekenhuizen, maar het percentage FTR is ruim hoger dan bij de gemiddelde ziekenhuizen, met als resultaat een hoge postoperatieve mortaliteit.
Verbeterinitiatieven zouden zich dus vooral moeten richten op de groep ziekenhuizen met gemiddelde tot lage percentages complicaties maar met een hoge postoperatieve mortaliteit.
Colon- en rectumresecties
Complicaties kwamen frequenter voor bij patiënten met een rectumcarcinoom (37%) dan bij patiënten met een coloncarcinoom (30%). Ook een gecompliceerd beloop trad frequenter op bij patiënten met een resectie voor een rectumcarcinoom: 23% van de patiënten met een rectumcarcinoom en 19% van de patiënten met een coloncarcinoom. Echter, een gecompliceerd beloop liep vaker fataal af na een colon- dan na een rectumresectie: FTR-percentages waren respectievelijk 19 en 9%.
Bij patiënten met een coloncarcinoom waren de FTR-percentages vooral hoog bij patiënten die een acute c.q. urgente resectie ondergingen, 26% ten opzichte van 17% bij electieve resecties. Ook bij patiënten met metastasen waren de FTR-percentages hoog, 26% ten opzichte van 19% bij lagere tumorstadia. Bij patiënten met een rectumcarcinoom was het FTR-percentage niet hoger bij patiënten met metastasen, maar wel bij urgente of acute resecties, namelijk 27%. Rectumresecties in een urgente of acute setting komen echter zeer weinig voor.
Wanneer er een serieuze complicatie optreedt, hebben patiënten met een coloncarcinoom dus een meer dan twee keer zo grote kans hieraan te overlijden dan patiënten met een rectumcarcinoom. Dit verklaart de hogere mortaliteit bij patiënten met een coloncarcinoom ten opzichte van patiënten met rectumcarcinoom. In deze paragraaf gaan we in op de incidentie van verschillende complicaties en belichten we welke complicaties relatief vaak tot sterfte leiden. Hiervoor is de database van patiënten geopereerd in 2011 en 2012 genomen, omdat vanaf 2011 er ook gedetailleerde informatie over niet-chirurgische (algemene) complicaties in de DSCA wordt geregistreerd. Gegevens van alle patiënten met complicaties, en niet alleen die met een gecompliceerd beloop, werden geanalyseerd.
Een algemene complicatie omschrijven we als een complicatie die niet direct terug te voeren is op het chirurgisch handelen, zoals een postoperatieve longontsteking, een urineweginfectie of een hartinfarct. Een chirurgische complicatie wordt gedefinieerd als een complicatie die direct terug te voeren is op het chirurgisch handelen, zoals naadlekkage, een (niet-preëxistent) abces of een nabloeding. Er zijn patiënten bij wie zowel een (of meerdere) chirurgische als een (of meerdere) algemene complicatie(s) optreden.
Onder naadlekkages vallen alle reïnterventies voor lekkages van de darmnaad en intra-abdominale abcessen bij patiënten met een darmnaad. In de groep “abcessen” vallen de intra-abdominale abcessen bij patiënten zonder darmnaad, exclusief de patiënten die preoperatief al een abces hadden op basis van een tumorperforatie.
Colonresecties
Van de patiënten met een complicatie had 34% alleen een chirurgische complicatie, 39% alleen algemene complicaties en 22% had een combinatie van chirurgische en algemene complicaties. Van 5% van de complicaties was geen nadere specificatie.
De mortaliteit was 7% bij patiënten met alléén een chirurgische complicatie, die opliep tot 18% bij patiënten bij wie één bijkomende algemene complicatie optrad en 29% bij patiënten met twee of meer algemene complicaties bij de chirurgische complicatie. In de patiëntengroep zonder chirurgische complicaties liep de mortaliteit op van 11% bij één algemene complicatie tot 25% bij twee of meer algemene complicaties.
Figuur 3 laat de verhouding tussen de incidentie van, en overlijden secundair aan verschillende typen complicaties zien voor patiënten met coloncarcinoom. De getallen geven de absolute aantallen patiënten weer. Opgemerkt moet worden dat patiënten combinaties van complicaties kunnen hebben gehad.
De meest voorkomende complicaties waren darmnaadlekkage en het postoperatief optreden van pulmonale problemen, zoals een pneumonie (longontsteking). Naadlekkage trad bij 726 patiënten op: 5,6% van alle patiënten met een colonresectie en 6,5% van alle patiënten met een colonresectie waarbij een darmnaad werd aangelegd. Pulmonale complicaties traden op bij 918 patiënten: 7% van alle patiënten geopereerd aan een coloncarcinoom. Van de patiënten bij wie een naadlekkage optrad, overleed 12%. Een nabloeding of een intra-abdominaal abces waren eveneens gerelateerd aan een hoge kans op overlijden, namelijk 20%, maar komen beide iets minder frequent voor. Sterfte was eveneens hoog na pulmonale complicaties (20%) en cardiale complicaties (27%).
Wanneer alle overleden patiënten nader worden bekeken, blijkt dat 48% van de patiënten die overleden na een colonresectie géén chirurgische complicatie, maar alleen algemene complicaties hadden.
Duidelijk wordt dus dat de kans op sterfte na chirurgische complicaties sterk toeneemt wanneer er (mogelijk secundair hieraan) bijkomende algemene complicaties optreden. Bovendien brengen algemene complicaties die geïsoleerd voorkomen ook een hoog risico op overlijden met zich mee. In ruwweg de helft van alle sterfgevallen na colonresecties was er alleen sprake van algemene, niet-chirurgische complicaties.
Rectumresecties
Alhoewel ook bij patiënten met een rectumcarcinoom naadlekkages de grootste groep chirurgische complicaties vormde, kenden deze complicaties relatief lage mortaliteitspercentages: 4,5% van de naadlekkages liep fataal af, in totaal 10 sterfgevallen in 2011 en 2012. Ook bij patiënten met een rectumcarcinoom zien we de hoogste mortaliteitspercentages na een pulmonale (17%) of cardiale (20%) complicatie. Ook hier geldt dat het optreden van een chirurgische complicatie een cascade aan algemene complicaties kan induceren. De mortaliteit was 2,7% bij patiënten met alléén een chirurgische complicatie. Dit percentage loopt op tot 10% bij patiënten met hierbij één algemene complicatie. Wanneer naast een chirurgische complicatie twee of meer algemene complicaties optreden is de kans op mortaliteit zelfs 25%. De mortaliteit was 4,9% bij patiënten met één geïsoleerde algemene complicatie, oplopend tot 17% in de groep van patiënten bij wie twee of meer algemene complicaties optraden na de operatie.
Wanneer alle overleden patiënten nader worden bekeken, blijkt dat 43% van de patiënten die overleden na een rectumresectie géén chirurgische complicatie, maar alleen algemene complicaties hadden.
Risicofactoren
Dat het percentage FTR hoger is bij patiënten met een coloncarcinoom dan bij patiënten met een rectumcarcinoom kan deels te maken hebben met verschillen in patiëntkarakteristieken: patiënten met coloncarcinoom zijn over het algemeen ouder en hebben vaker en meer comorbiditeit (zie hoofdstuk 2 “Resultaten” ). Bovendien is het percentage urgente of acute operaties groter bij patiënten met een coloncarcinoom. Echter, het verschil in FTR blijft bestaan wanneer alleen naar electieve operaties wordt gekeken: 17% bij patiënten met coloncarcinoom tegenover 8% bij patiënten met een rectumcarcinoom.
Sterfte was relatief hoog na cardiale en pulmonale complicaties. Uit de multivariate logistische regressie analyse kwam, gecorrigeerd voor de andere casemixfactoren, dat de kans op cardiale complicaties 2,5 keer zo groot was bij patiënten met reeds bestaande cardiale comorbiditeit. Dit was samen met een leeftijd van boven de 70 jaar de sterkste risicofactor. De kans op overlijden bij een cardiale complicatie was echter niet significant verhoogd bij patiënten met specifiek cardiale comorbiditeit. Hier waren het mannelijk geslacht en chronische nierinsufficiëntie de belangrijkste risicofactoren.
Het risico op pulmonale complicaties was verhoogd bij patiënten boven de 70, patiënten met neurologische comorbiditeit en vooral bij patiënten met pulmonale comorbiditeit. De kans op overlijden gegeven een pulmonale complicatie liet het hoogste risico zien bij patiënten op hogere leeftijd die uitgebreide aanvullende resecties in verband met een lokaal uitgebreide tumor hadden ondergaan; pulmonale comorbiditeit was hier geen specifiek risico.
Anatomie
Bij het verschil in “failure to rescue” tussen patiënten met een colon- en rectumcarcinoom kan de anatomische locatie van de tumor, en hiermee samenhangend het operatiegebied, een rol spelen. De darmnaad ligt na een rectumresectie niet in de vrije buikholte maar in het kleine bekken. Dit heeft tot gevolg dat een naadlekkage na een rectumresectie zich vaker beperkt tot een afgekapseld gebied, bijvoorbeeld leidend tot een presacraal abces of fistel; terwijl een naadlekkage na een colonresectie eerder tot een gegeneraliseerde peritonitis en abdominale sepsis zal leiden.
Tot slot is het niet uitgesloten dat rectumchirurgie vaker door een gespecialiseerd team wordt uitgevoerd dan colonchirurgie. Recent is er voor de rectumchirurgie een minimale volumenorm van 20 resecties per jaar vastgesteld door de Nederlandse Vereniging voor Heelkunde, die zal leiden tot verdere concentratie van rectumresecties. Vast staat dat een relatief hoge mortaliteit optreedt na complicaties volgend op colonresecties, ook bij electieve resecties en in de niet-gemetastaseerde setting. Dit is een duidelijk aangrijpingspunt voor verdere kwaliteitsverbetering.
Time to rescue
Chirurgische complicaties zoals naadlekkage brengen dus een hoge kans op sterfte met zich mee, vooral bij patiënten die een colonresectie ondergaan. Een naadlekkage kan een ernstige verslechtering van de klinische toestand van de patiënt veroorzaken, waardoor er geïsoleerd of multipel orgaanfalen (bijvoorbeeld nierinsufficiëntie, longfalen) kan optreden. Het verschilt per patiënt, afhankelijk van onder andere de leeftijd en de gezondheid vóór de operatie, hoeveel reservecapaciteit de organen hebben om een dergelijke situatie te compenseren. Er wordt daarom wel gesuggereerd dat een vroege reïnterventie bij een (verdenking op) een naadlekkage de postoperatieve mortaliteit kan reduceren. Een grootschalige observationele Britse studie vond dit verband niet6. Echter, de reïnterventies in deze studie vonden relatief laat plaats (mediaan op 8e postoperatieve dag), zowel in de ziekenhuizen met een hoge als die met een lage sterfte. Een Franse serie van 655 patiënten liet zien dat van de patiënten met naadlekkage, 22% kwam te overlijden bij een reoperatie na 5 dagen, tegen 0% bij een reoperatie binnen 5 dagen7.Dit verschil was echter niet significant vanwege de kleine aantallen patiënten in deze studie. Om meer inzicht te krijgen in de vermeende relatie tussen de tijd tot reïnterventie en FTR is de DSCA in 2012 gestart met het registreren van de datum van de reïnterventie.
In 2012 vonden er 391 reoperaties voor naadlekkages plaats. Bij 59 patiënten (15%) was de datum van reoperatie niet bekend. Van de 332 patiënten waarbij dit wel het geval was lag de piek op de dagen 3 t/m 7.
Figuur 4 laat het verschil in sterfte zien tussen patiënten met naadlekkage bij wie een reoperatie werd uitgevoerd binnen 5 dagen na de operatie, afgezet tegen de patiënten bij wie op een later tijdstip werd gereopereerd. Met de 5epostoperatieve dag als afkappunt blijkt het verschil in sterfte tussen vroege reoperaties en late reoperaties het grootste te zijn, met de meest gunstige resultaten voor patiënten bij wie vroeg ingegrepen werd. Dit mortaliteitsverschil is 9% versus 13%. De kans op sterfte na een reoperatie voor naadlekkage is dus 1,4 keer zo groot wanneer deze na dag 5 plaatsvindt. Alhoewel dit verschil bij deze relatief kleine groep patiënten niet statistisch significant is, lijkt het wel relevant. Het is waarschijnlijk dat met DSCA-gegevens over meerdere jaren hierover in de toekomst betrouwbaardere uitspraken gedaan kunnen worden.
Er is weinig literatuur over het effect van een vroege reïnterventie bij postoperatieve complicaties. Het is bekend dat geprotocolliseerde postoperatieve surveillance na colorectale resectie tot het vroeger vaststellen van naadlekkages kan leiden8. Bovendien zijn er aanwijzingen dat gedurende de diensturen in het weekend vertraging in het vaststellen van naadlekkage op kan treden9. Mogelijk valt hier op landelijk niveau winst te behalen, bijvoorbeeld door striktere patiëntenmonitoring10, met speciaal hiervoor ontwikkelde instrumenten, zoals de Early Warning Score (EWS)11 12 13 14. Het meten van het C-reactive protein (CRP) op postoperatieve dag 4 heeft een negatief voorspellende waarde van 89% voor infectieuze complicaties en is derhalve bruikbaar als simpel postoperatief monitoringsmiddel om patiënten die niet ‘at risk’ voor een infectieuze complicatie zijn te onderscheiden15.De mogelijkheid om een spoedinterventieteam (SIT team) in te schakelen kan wellicht ook helpen bij het tijdig herkennen en adequaat behandelen van patiënten met (meerdere) postoperatieve complicaties16 17. Tot slot kan de mate van beschikbaarheid van faciliteiten zoals beeldvorming en interventieradiologie mogelijk een rol spelen.
In de toekomst kunnen gegevens uit de DSCA mogelijk de basis vormen voor een beter inzicht in de factoren die hierin een rol spelen.
Referenties
1.Neo-adjuvante therapie rectumcarcinoom
Summary Samenvatting
- In de periode waarin neo-adjuvante therapie voor het rectumcarcinoom is vastgelegd in de DSCA (2009-2012) is er recent een trendbreuk te zien in het gebruik van neo-adjuvante radiotherapie. Tot 2011 steeg het aantal patiënten met een rectumcarcinoom dat neo-adjuvant behandeld werd. De toepassing van radiotherapie bij het hoge en kleine rectumcarcinoom wordt door steeds meer mensen beschouwd als overbehandeling. In de nieuwe richtlijn is de indicatiestelling aangepast voor deze groep patiënten. In de aanloop hiernaartoe wordt er reeds een daling in het gebruik van neo-adjuvante therapie gezien (86% van de patiënten met een rectumcarcinoom in 2011 tegenover 77% in 2012). Naar verwachting zal deze aanpassing van de richtlijn een verdere daling van het gebruik van neo-adjuvante radiotherapie geven.
- De neiging tot overstadiëring van het N-stadium op basis van MRI, zoals blijkt uit de DSCA (49%), werkt overbehandeling in de hand. Dit is een bekend fenomeen bij de introductie van nieuwe beeldvormende modaliteiten. Het is te verwachten dat meer ervaring met de MRI in de work-up bij het rectumcarcinoom mogelijk zal leiden tot een scherpere indicatiestelling. Indien de grote spreiding tussen de ziekenhuizen aanhoudt, suggereert dit een noodzaak tot verdere standaardisatie van de MRI-beoordeling ten aanzien van het N-stadium.
- In de gemetastaseerde setting wordt vaker afgezien van neo-adjuvante behandeling en wordt het korte schema met kort interval tot chirurgie relatief minder vaak toegepast, hoewel dit alleen voor de streek- en opleidingsziekenhuizen geldt en niet voor de academische centra. De resultaten uit de M1-studie hebben geresulteerd in een toename in het gebruik van het korte schema gevolgd door systemische chemotherapie, met name in de opleidings- en academische ziekenhuizen.
- Na chemoradiotherapie wordt steeds langer gewacht met opereren, met name in de academische ziekenhuizen, waar het interval in het merendeel van de patiënten zonder metastasen langer is dan 10 weken na beëindiging van de bestraling. In de literatuur komen er meer aanwijzingen dat een verlenging tussen bestraling en chirurgie, in bepaalde patiëntengroepen, betere resultaten geeft. In de gemetastaseerde setting wordt de wachttijd na radiotherapie veelal benut door systemische chemotherapie te geven.
- Er wordt een hoog percentage positieve CRM’s (< 1 mm) gevonden voor een pathologisch T4-stadium, ook na chemoradiotherapie. Patiënten met een T4-rectumcarcinoom en afwezige of geringe respons op neo-adjuvante therapie verdienen daarom extra aandacht ten aanzien van de radicaliteit van de resectie.
- In Nederland schrijft de richtlijn niet voor dat patiënten met een stadium III rectumcarcinoom adjuvant behandeld moeten worden. Dat verklaart dat er relatief weinig adjuvante chemotherapie gegeven wordt bij deze groep patiënten. Er is veel discussie in de literatuur of adjuvante chemotherapie van toegevoegde waarde is na neo-adjuvante (chemo)radiotherapie. Dit vertaalt zich in een grote spreiding die gezien wordt tussen de ziekenhuizen in het toepassen van deze therapie.
De bijdrage van neo-adjuvante radiotherapie bij het resectabele rectumcarcinoom is bij kwalitatief goede TME-chirurgie beperkt. Bij het lokaal gevorderde rectumcarcinoom is er een belangrijke plaats voor neo-adjuvante radiotherapie om tumorverkleining en stadiumverlaging te bewerkstelligen. Daarmee wordt de kans op een radicale resectie verhoogd en de kans op een lokaal recidief significant en substantieel verkleind. Neo-adjuvante therapie kan echter nooit een suboptimale operatie compenseren en een radicale resectie is nog steeds de hoeksteen van de behandeling van het rectumcarcinoom. Het bewaken en verbeteren van de kwaliteit van de chirurgische behandeling is daarom cruciaal.
Toegevoegde waarde
Voor het primair resectabel rectumcarcinoom is er veel discussie ontstaan over de toegevoegde waarde van neo-adjuvante radiotherapie, vooral bij een laag stadium rectumcarcinoom (stadium I en II). Voor de totale groep patiënten met een resectabel rectumcarcinoom is de overleving gelijk1. Uit analyse van de belangrijke gerandomiseerde studies bleek er een significante stijging te zijn van niet-kanker gerelateerde sterfte door neo-adjuvante radiotherapie1,2. In de laagrisicogroep (T1-3N0) zou deze sterfte in absolute zin groter kunnen zijn dan de kanker-gerelateerde overlevingswinst. Daarnaast resulteert radiotherapie in een verslechtering van de functionele uitkomst, met name darmdysfunctie, wat een belangrijk aspect vormt in de afweging om al dan niet te besluiten tot neo-adjuvante behandeling.
Een belangrijke uitdaging vormt dus het selecteren van patiënten met een resectabel rectumcarcinoom die baat hebben bij neo-adjuvante radiotherapie. Preoperatieve MRI heeft een belangrijke bijdrage geleverd aan de klinische stadiëring en is nauwkeurig in het bepalen van de afstand van de tumor tot de mesorectale fascie (MRF). De relatief lage accuratesse van MRI in het vaststellen van het N-stadium, en daarmee het relatieve onvermogen om de patiënten met een resectabel stadium III rectumcarcinoom te selecteren voor neo-adjuvante behandeling, vormt echter een belangrijk klinisch probleem3.
Richtlijn
In het hoofdstuk neo-adjuvante therapie van het DSCA-jaarrapport 2011 is uitgebreid ingegaan op de verschillende types neo-adjuvante therapie en de toepassing daarvan in Nederland4. Het hoge percentage patiënten met een rectumcarcinoom dat neo-adjuvant is behandeld in Nederland (85%) in vergelijking tot andere Europese landen (25 tot 60%) is hierin uitgebreid bediscussieerd. De Nederlandse richtlijn, daterend uit 2008, ligt hieraan ten grondslag. Dit jaar verschijnt de nieuwe richtlijn, waarin de indicatie voor neo-adjuvante radiotherapie bij het resectabel rectumcarcinoom is beperkt.
In dit hoofdstuk zal aandacht worden besteed aan het geïndividualiseerde beleid ten aanzien van neo-adjuvante therapie, de gemetastaseerde setting, het tijdsinterval tussen radiotherapie en chirurgie en de radicaliteit van de resectie na neo-adjuvante therapie. Tevens zal het controversiële onderwerp van adjuvante chemotherapie bij het rectumcarcinoom worden besproken. In deze analyses worden enkel de analyseerbare patiënten met een rectumcarcinoom (overlevingsstatus, operatiedatum en tumorlocatie bekend) meegenomen die in een electieve setting geopereerd zijn.
Neo-adjuvante radiotherapie
In dit hoofdstuk worden, conform het vorige hoofdstuk uit 2011, drie verschillende vormen van radiotherapie onderscheiden:
- Kortdurende neo-adjuvante radiotherapie in 5 fracties van 5 Gy met een kort interval tot TME-chirurgie, afgekort met SCRT (short course radiotherapy) zoals gebruikelijk in de Engelstalige literatuur.
- Kortdurende neo-adjuvante radiotherapie in 5 fracties van 5 Gy met een lang interval tot TME-chirurgie, afgekort met SCRT-DS (short course radiotherapy with delayed surgery).
- Lang schema neo-adjuvant radiotherapie in 25 fracties van 2 Gy of 28 fracties van 1,8 Gy, in combinatie met chemotherapie (meestal capecitabine) gedurende de radiotherapie. Het lange schema zonder chemotherapie omvat slechts een kleine subgroep. Deze wordt niet apart vermeld in de analyses en ondergebracht onder de gezamenlijke afkorting CRT (chemoradiotherapie).
In de periode 2009 tot en met 2012 zijn 9.837 patiënten (9.534 analyseerbaar en electief geopereerd) met een rectumcarcinoom geregistreerd in de DSCA. In deze periode zijn belangrijke trends te zien in de toepassing van de verschillende vormen van radiotherapie, zoals afgebeeld in figuur 1. Vooruitlopend op de nieuwe richtlijn is er een trendbreuk te zien met een lichte stijging in chirurgie zonder radiotherapie in 2012 ten opzicht van een afname tot 2011. Ook in het gebruik van CRT is een trendbreuk te zien met een geringe stijging tot 2011 en een afname van enkele procenten in 2012. Evenals in de chirurgie zonder neo-adjuvante radiotherapie wordt ook een toename gezien in SCRT-DS. Deze toenames zijn ten koste gegaan van de toepassing van SCRT met kort interval tot chirurgie.
Therapie op maat
Een geïndividualiseerd beleid op basis van patiëntkarakteristieken wordt bepaald op basis van leeftijd en comorbiditeit. Het percentage CRT is de helft minder bij oudere patiënten met een leeftijd boven de 75 jaar (21 vs. 44%). Bij oudere patiënten wordt vaker afgezien van radiotherapie (25 vs. 15%) en wordt relatief minder vaak voor CRT gekozen (48% vs. 38%). SCRT-DS is een goed alternatief voor CRT en laat een verdubbeling zien boven de 75 jaar (6,9% vs. 3,2%). Ook is er een toename te zien in het gebruik van SCRT met kort interval tot chirurgie boven de 75 jaar (48 vs. 38%). Een Charlsonscore van 2 of hoger laat een afname van 10% zien in CRT ten opzichte van patiënten zonder comorbiditeit. Deze afname vertaalt zich volledig in een toename van chirurgie zonder voorbehandeling.
Voor wat betreft tumorkenmerken wordt het distale rectumcarcinoom (onderrand tumor <5 cm van de anus) in 90% voorbehandeld met radiotherapie, waarvan CRT het merendeel vormt (51%). Bij tumoren op meer dan 10 cm van de anus wordt in 33% afgezien van radiotherapie, en is het aandeel CRT in neo-adjuvante therapie voor het proximale rectumcarcinoom 22%.
Toepassing van neo-adjuvante radiotherapie voor de verschillende klinische stadia is weergegeven in figuur 2. Conform de richtlijn wordt een toename in de toepassing van chemoradiotherapie gezien bij een toenemend N-stadium binnen elke T-categorie en worden de lokaal gevorderde tumoren vrijwel routinematig neo-adjuvant behandeld.
Overbehandeling
In de DSCA kan een indruk verkregen worden over de accuratesse van MRI voor N-stadiëring zoals die op populatieniveau in de dagelijkse praktijk tot stand komt. De over- en onderstadiëring van MRI kan worden bepaald door het klinisch en pathologisch N-stadium te vergelijken bij de patiënten die geen neo-adjuvante therapie kregen of geen stadiumverlaging hadden na SCRT met directe operatie. Van 1.431 patiënten met de verdenking op lymfkliermetastasen op de MRI bleken 703 patiënten een pathologisch N0-stadium te hebben (49% overstadiëring). Daarentegen hadden 731 van totaal 2.641 patiënten met een cN0-stadium pathologisch bewezen lymfkliermetastasen (28% onderstadiëring).
Op basis van deze data kan gesteld worden dat er een neiging tot overbehandelen ontstaat op basis van de N-stadiëring bij preoperatieve MRI, die groter lijkt dan de kans op onderbehandelen. In de nieuwe richtlijn zal een klinisch N1-stadium een belangrijk criterium worden voor SCRT en een klinisch N2-stadium een indicatie vormen voor CRT conform de huidige richtlijn. Anticiperend op de neiging tot overstadiëring op basis van MRI, zullen de criteria voor verdenking op lymfkliermetastasen worden aangepast in de nieuwe richtlijn.
Ziekenhuisverschillen
In figuur 3 wordt per ziekenhuis het percentage overstadiëring van lymfkliermetastasen weergegeven bij patiënten die een rectumresectie ondergingen zonder neo-adjuvante therapie of na SCRT met een kort interval. De grote spreiding kan mogelijk wijzen op verschillen in beoordeling door de radiologen van de desbetreffende ziekenhuizen en de interpretatie van de bevindingen in de verschillende MDO’s.
Opvallend is de uitgebreide toepassing van neo-adjuvante therapie bij patiënten met een stadium I (T1-2N0) rectumcarcinoom in Nederland over de afgelopen 4 jaar (figuur 4). Dit percentage was 76% in 2009, 77% in 2010, 81% in 2011 en 62% in 2012, terwijl zelfs in de huidige richtlijn een T1N0-stadium geen indicatie vormt voor radiotherapie. In de nieuwe richtlijn komt de indicatie voor neo-adjuvante therapie bij stadium I in zijn geheel te vervallen (dus ook bij T2N0).
Nieuwe richtlijn
Bij volledige implementatie van de nieuwe richtlijn is er een daling van neo-adjuvante therapie voor het laagrisico rectumcarcinoom te verwachten in de komende jaren. Er is echter ook in toenemende mate aandacht voor rectumsparende behandeling bij vroegcarcinomen, met name distaal gelegen. In de Nederlandse CARTS-studie is in dit kader chemoradiotherapie gevolgd door transanale endoscopische microchirurgie (TEM) onderzocht voor klinisch T1-3N0-tumoren. Deze trend heeft een tegengesteld effect met juist een toename van neo-adjuvante therapie voor het laagrisico rectumcarcinoom.
Gemetastaseerde setting
Voor patiënten met bewezen metastasen op afstand zijn er geen duidelijke richtlijnen voor het toepassen van neo-adjuvante therapie. Er wordt dan vaak een sterk geïndividualiseerd beleid gevoerd op basis van de uitgebreidheid van zowel de lokale tumor als de metastasen.
Locoregionale controle is ook in de gemetastaseerde setting een belangrijk uitgangspunt voor de behandeling. Maar tegelijkertijd is het belangrijk bij resectabele metastasen niet de controle over de systemische ziekte te verliezen. De volgorde van de verschillende behandelingscomponenten (systemische chemotherapie, locoregionale radiotherapie, primaire tumorresectie, resectie of RFA van metastasen) dient daarom zorgvuldig gekozen te worden, waarbij geen wetenschappelijk bewijs voorhanden is dat de uiteindelijke keuze kan ondersteunen5. Voor deze subgroep van patiënten is dus bespreking in een multidisciplinair overleg bij uitstek van aanvullende waarde6.
In figuur 5 is te zien dat er duidelijke verschuivingen optreden in de keuze voor neo-adjuvante therapie, afhankelijk van de aanwezigheid van metastasen. Voor alle T-stadia is eenzelfde patroon te zien waarbij het aandeel SCRT en CRT afneemt en er vaker geen radiotherapie wordt gegeven of SCRT met uitgestelde chirurgie.
Het SCRT-DS schema met systemische chemotherapie in het interval tussen de radiotherapie en chirurgie is na de goede resultaten uit de M1-studie populair geworden in Nederland7. Echter, bij een T4-stadium wordt toch nog steeds de voorkeur gegeven aan CRT. De literatuur laat daarentegen zien dat ook voor het T4-stadium het SCRT-DS schema een goede keuze kan zijn met adequate tumorverkleining en stadiumverlaging8,9,10.
Ziekenhuistypen
Als onderscheid gemaakt wordt tussen typen ziekenhuizen, zijn er duidelijke verschillen te zien in toepassing van neo-adjuvante therapie bij patiënten met en zonder metastasen (tabel 1). Allereerst is er een verschil in casemix te zien, met een relatief groot aandeel van het M1-stadium in de universitaire ziekenhuizen (16%) ten opzichte van de algemene ziekenhuizen, die weer onder te verdelen zijn in opleidings- en niet opleidingsziekenhuizen (respectievelijk 7% en 5% M1-patiënten). In de gemetastaseerde setting wordt er in streekziekenhuizen vaker afgezien van neo-adjuvante radiotherapie, terwijl in de universitaire ziekenhuizen juist een klein verschil in de tegenovergestelde richting wordt gezien. In de niet-gemetastaseerde setting wordt in de streekziekenhuizen veel SCRT toegepast, terwijl dit in de universitaire centra opvallend lager is. Dit heeft meest waarschijnlijk te maken met selectie van gevorderde stadia in de universitaire centra.
| M status | N | Geen | SCRT | SCRT-DS | CRT | |
| (%) | (%) | (%) | (%) | |||
| Streekziekenhuis | 0 | 2389 | 14% | 48% | 3,2% | 34% |
| 1 | 118 | 28% | 26% | 6,8% | 39% | |
| Opleidingsziekenhuis | 0 | 5730 | 19% | 43% | 2,8% | 36% |
| 1 | 459 | 25% | 24% | 13% | 38% | |
| Academisch ziekenhuis | 0 | 702 | 12% | 19% | 10% | 58% |
| 1 | 136 | 10% | 20% | 15% | 55% |
Toepassing van het M1-schema (SCRT-DS met interval chemotherapie) is vergelijkbaar tussen de opleidingsziekenhuizen en universitaire ziekenhuizen, maar wordt minder vaak toegepast in de niet-opleidingsziekenhuizen. Mogelijk is dit gerelateerd aan het sneller implementeren van nieuwe ontwikkelingen in universitaire ziekenhuizen en opleidingsziekenhuizen. Het relatief vaker uitstellen van de chirurgie na SCRT bij M0-stadium in de universitaire ziekenhuizen is mogelijk gerelateerd aan de logistiek in deze centra. Tot slot is er een hoger gebruik van CRT in de universitaire ziekenhuizen, onafhankelijk van het M-stadium, duidend op relatief meer gevorderde tumoren.
Tijdsinterval
Het tijdsinterval tussen chemoradiotherapie en chirurgie laat in recente jaren een verschuiving zien van de gebruikelijke 6 tot 8 weken naar een langer interval van 10 tot 12 weken. Op basis van de DSCA-registratie is de relatie tussen dit tijdsinterval en de kans op een pathologisch complete respons geanalyseerd11. Opereren in week 15 en 16 na de start van de chemoradiotherapie, dus ongeveer 10 tot 11 weken na het afronden van de bestraling, was geassocieerd met de grootste kans op een pathologisch complete respons. Het interval tot chirurgie bleek de enige onafhankelijk voorspeller voor pathologisch complete respons in multivariate analyse.
De literatuur is tegenstrijdig voor wat betreft het effect van langer wachten op de respons na chemoradiotherapie. Het wachten is op resultaten van lopende gerandomiseerde studies, zoals die van de National Institutes of Health, waarin verschillende intervallen tussen de 6 en 24 weken worden vergeleken, en de STARRCAT-studie waarin 6 en 12 weken wachttijd worden vergeleken.
Uit figuur 6 blijkt dat in niet-opleidings- en opleidingsziekenhuizen het grootste percentage van de patiënten zonder metastasen wordt geopereerd in week 13 en 14, overeenkomend met 8 tot 9 weken vanaf het einde van de chemoradiotherapie. In de universitaire ziekenhuizen wordt langer gewacht en wordt het merendeel van de patiënten met een tijdsinterval van meer dan 10 weken na afronding van de chemoradiotherapie geopereerd.
In de gemetastaseerde setting zijn er minder prominente verschillen tussen de ziekenhuizen en wordt het grootste percentage patiënten na een lang interval van meer dan 11 weken geopereerd. Deze wachttijd wordt dan meestal benut om optimale systemische chemotherapie te geven, bijvoorbeeld om resectabiliteit van de metastasen te bewerkstelligen.
Radicaliteit
Een tumorvrije circumferentiële marge (CRM) is één van de belangrijkste prognostische kenmerken gebleken voor het optreden van een lokaal recidief. Dit geldt niet alleen voor patiënten die alleen chirurgische behandeling hebben ondergaan, maar ook voor patiënten die met neo-adjuvante radiotherapie zijn behandeld.
Uit tabel 2 blijkt dat er veel patiënten zijn bij wie de CRM-status niet was geregistreerd. Dit was met name het geval bij de start van de DSCA met een stijging in de jaren daarna, zie hiervoor hoofdstuk 4 pathologie.
| Geen | SCRT | SCRT-DS | CRT | Totaal | ||
| CRM status | N (%) | N (%) | N (%) | N (%) | N (%) | |
| (y)pT0 | + | 0 | 0 | 0 | 0 | 0 |
| onbekend | 0/14 | 0/29 | 0/21 | 0/293 | 0/357 | |
| (y)pT1 | + | 5 (4,5) | 5 (2,6) | 0 | 4 (2,5) | 14 (2,9) |
| onbekend | 136/247 (55) | 85/277 (31) | 5/32 (16) | 71/229 (31) | 297/785 (38) | |
| (y)pT2 | + | 14 (4,9) | 34 (3,2) | 2 (2,2) | 25 (3,7) | 75 (3,5) |
| onbekend | 170/455 (37) | 431/1504 (29) | 19/108 (18) | 200/872 (23) | 820/2939 (28) | |
| (y)pT3 | + | 69 (15) | 148 (9,8) | 21 (13) | 186 (15) | 424 (13) |
| onbekend | 253/713 (36) | 420/1931 (22) | 29/189 (15) | 329/1601 (21) | 1031/4434 (23) | |
| (y)pT4 | + | 33 (58) | 21 (34) | 4 (31) | 74 (42) | 132 (43) |
| onbekend | 58/115 (50) | 27/89 (30) | 8/21 (43) | 78/253 (31) | 171/478 (36) |
In totaal werd er bij 357 patiënten geen resttumor meer gevonden. Dat dit soms ook het geval was zonder neo-adjuvante therapie of na SCRT met directe resectie kan verklaard worden door bijvoorbeeld een radicale endoscopische verwijdering van een maligne poliep.
Er is een verschil in de kans op een positieve CRM te zien tussen het (y)pT1-2 en (y)pT3-4 stadium. Het percentage positieve CRM is onder de 5% als de tumor beperkt bleek tot de rectumwand (pT1-2), onafhankelijk van het type neo-adjuvante therapie. Voor het pathologische T3-stadium wordt een hoger percentage positieve CRM gezien van 10 tot 15%, waarbij het hogere percentage voor de patiënten die CRT ondergingen waarschijnlijk te maken heeft met de uitgebreidheid van de T3-tumor (relatie tot de MRF, mate van extramurale invasie). Voor de pathologische T4-tumoren wordt een hoog percentage irradicaliteit gezien. Zonder voorbehandeling bedroeg dit 58%, maar ook na CRT werd in 42% van de (y)pT4-tumoren een positieve CRM gevonden.
Mogelijk is er voor de T4-tumoren nog ruimte voor verbetering, waarbij met name een T4 bij re-stadiërings MRI een belangrijk risico vormt. Daarbij valt te denken aan ruimere resecties, zoals exenteratieve ingrepen. In een literatuuroverzicht van gerandomiseerde studies bleek de invloed van een positieve CRM (<1 mm) op het lokaal recidief percentage zelfs groter na neo-adjuvante therapie dan zonder voorbehandeling (HR 6,3 vs. 2,0)12. Dit kan verklaard worden door het slechtere biologische gedrag van tumoren met niet of nauwelijks respons op neo-adjuvante therapie, waarbij de kans op een positieve CRM logischerwijs groter is.
De rol van intraoperatieve radiotherapie (IORT) is nog steeds controversieel door de afwezigheid van gerandomiseerde studies, maar kan mogelijk compenseren voor een microscopisch irradicale resectie. Concentratie van zorg voor patiënten met een T4 -rectumcarcinoom lijkt essentieel, gezien de complexiteit van de behandeling.
Adjuvante chemotherapie
Nationaal en internationaal is er veel discussie over de waarde van adjuvante chemotherapie bij het stadium III rectumcarcinoom. Een recente gepoolde analyse van Europese gerandomiseerde studies naar effecten van perioperatieve radiotherapie laat een voordeel zien van adjuvante chemotherapie, maar deze data zijn moeilijk te interpreteren, omdat deze studies niet waren bedoeld om het effect van adjuvante chemotherapie aan te tonen13. Dit jaar verscheen een Cochrane review waarbij ook werd geconcludeerd dat er een overlevingsvoordeel is van adjuvant 5-FU gebaseerde chemotherapie bij het rectumcarcinoom14. De auteurs merken echter op dat het onduidelijk is of deze data toepasbaar zijn in de huidige praktijk met neo-adjuvante chemoradiotherapie, mede gezien de EORTC trial die ten aanzien van deze vraagstelling geen effect liet zien15.
De discussie over de waarde van adjuvante chemotherapie bij het rectumcarcinoom wordt geïllustreerd door de funnelplot die een grote spreiding laat zien tussen de Nederlandse ziekenhuizen (figuur 7).
Referenties:
1.
Samenvatting DUCA
In 2011 ging de Dutch Upper GI Cancer Audit (DUCA) van start met als doel betrouwbare informatie te genereren voor kwaliteitsmonitoring en -verbetering van de (chirurgische) behandeling van patiënten met een slokdarm- of maagcarcinoom. In dit jaarrapport worden de resultaten van het tweede registratiejaar gepresenteerd.
Landelijke dekking
In 2012 werden 739 geopereerde patiënten met een slokdarmcarcinoom en 471 geopereerde patiënten met een maagcarcinoom geregistreerd in de DUCA. De landelijke dekking van de DUCA is daarmee toegenomen ten opzichte van 2011. Op basis van gegevens van de Nederlandse Kanker Registratie (NKR) over 2011 is de landelijke dekking van de DUCA in 2012 naar schatting 91% van het totaal aantal slokdarmkankerresecties en 82% van het totaal aantal maagkankerresecties (zie hoofdstuk 1 “Volledigheid en betrouwbaarheid”). In 2012 participeerden 42 ziekenhuizen. Het aantal geregistreerde patiënten per ziekenhuis varieerde sterk (figuur 1).
Validatie
Voor een vergelijking van de gegevens in de DUCA met die van de NKR is gekeken naar het jaar 2011. In de DUCA 2011 zijn de aantallen patiënten per ziekenhuis soms hoger en soms lager dan die in de NKR in 2011.
De 30-dagen mortaliteit komt voor patiënten met een slokdarmcarcinoom op landelijk niveau matig overeen tussen de DUCA en de NKR in 2011 (respectievelijk 1,1% en 2,2%). Ook op ziekenhuisniveau zijn er verschillen in deze uitkomstparameter tussen de twee registraties. Wanneer sprake is van een verschil in mortaliteit, is deze iedere keer lager in de DUCA dan in de NKR. Voor patiënten met een maagcarcinoom komt de 30-dagen mortaliteit beter overeen tussen beide registraties (7,0% en 6,9%). Ook hier is op ziekenhuisniveau af en toe een lagere mortaliteit in de DUCA dan in de NKR geregistreerd, maar het omgekeerde wordt ook gezien. Wanneer de NKR gegevens over 2012 beschikbaar komen zal blijken of de (mortaliteits)registratie in de DUCA in 2012 beter overeenkomt met de NKR dan in 2011. Validatie van de aantallen geregistreerde patiënten en de sterftecijfers op ziekenhuisniveau is een essentiële stap op weg naar transparantie.
Voor wat betreft een aantal pathologische parameters (het percentage patiënten met een R0 resectie en het percentage patiënten met tien of meer onderzochte lymfeklieren) is er een redelijke overeenstemming tussen de beide registraties, zowel op landelijk niveau als op ziekenhuisniveau.
Diagnostisch proces
Bij het merendeel van de patiënten in de DUCA wordt de diagnostiek volgens de landelijke richtlijnen toegepast (zie hoofdstuk 2 “Resultaten en kwaliteitsparameters”). Tussen 2011 en 2012 is een toename te zien in de toepassing van PET-CT bij patiënten met een klinisch T3 slokdarmcarcinoom (van 52% naar 73%). Bij patiënten met een maagcarcinoom is ondanks de adequate invulling van het diagnostisch proces het klinisch TNM stadium bij bijna de helft van de patiënten onbekend. Dit is te verklaren vanuit de beperkingen van het endoscopisch en CT onderzoek om de mate van tumoringroei in de maagwand en het aantal tumorpositieve lymfeklieren vast te stellen.
Wachttijden
De wachttijden tussen datum van diagnose en start van de behandeling zijn in beide patiëntengroepen lang (mediaan zes weken bij patiënten met een slokdarmcarcinoom en vijf weken bij patiënten met een maagcarcinoom). De Treeknorm (start behandeling binnen vijf weken na diagnose) wordt gehaald bij slechts 31% van de patiënten met een slokdarmcarcinoom en bij 42% van de patiënten met een maagcarcinoom. Hierbij wordt een forse spreiding tussen ziekenhuizen gezien (zie hoofdstuk 2 “Resultaten en kwaliteitsparameters”).
Behandeling
De toepassing van preoperatieve therapie is gelijk gebleven ten opzichte van 2011: 89% van de patiënten met een slokdarmcarcinoom en 55% van de patiënten met een maagcarcinoom wordt voorbehandeld. Opvallend is de variatie tussen ziekenhuizen, die groot is bij het maagcarcinoom, maar ook bij het slokdarmcarcinoom varieert tussen 60 en 100% (figuur 2).
Bij het slokdarmcarcinoom wordt vanaf 80 jaar en bij het maagcarcinoom vanaf 70 jaar steeds vaker afgezien van perioperatieve behandeling (zie hoofdstuk 4 (Neo)adjuvante therapie bij het slokdarm- en maagcarcinoom”). Co-morbiditeit speelt waarschijnlijk vooral bij het maagcarcinoom een (grote) rol in deze beslissing. Het preoperatieve chemoradiotherapie-schema bij patiënten met een slokdarmcarcinoom wordt vrijwel altijd afgemaakt. De geplande preoperatieve chemotherapie-kuren worden minder vaak volledig afgerond, zeker bij patiënten met een maagcarcinoom (21% van deze patiënten maakt deze voorbehandeling niet af). Het percentage patiënten met een maagcarcinoom dat ook postoperatieve chemotherapie ondergaat is laag (37%).
Voor wat betreft de operatietechniek valt op dat in 2012 het percentage patiënten met een slokdarmcarcinoom dat een resectie ondergaat via een transthoracale (i.p.v. transhiatale) benadering is toegenomen van 45% naar 55%. Daarnaast is het percentage patiënten met een slokdarmcarcinoom dat minimaal invasief geopereerd wordt iets toegenomen (van 37% naar 41%), terwijl de meeste patiënten met een maagcarcinoom via een open benadering geopereerd worden (93%).
Postoperatief beloop
Evenals in 2011 is het percentage patiënten met een gecompliceerd postoperatief beloop hoger bij de patiënten met een slokdarmcarcinoom (32%) dan in de groep patiënten met een maagcarcinoom (23%).
De postoperatieve mortaliteit (binnen 30-dagen en/of in-het-ziekenhuis) voor patiënten met een slokdarmcarcinoom was in 2012 hetzelfde als in 2011 (4,4%). Voor patiënten met een maagcarcinoom werd in 2012 een lagere postoperatieve mortaliteit geregistreerd dan in 2011, maar deze is nog steeds hoog ( een daling van 8,8 naar 6,7%) . De sterfte na een operatie vanwege maagkanker treedt met name op bij patiënten die een palliatieve resectie of alleen een exploratieve laparotomie ondergaan.
Ziekenhuisvergelijkingen en casemix
Vanwege de kleine aantallen patiënten die na de operatie zijn overleden kunnen in de DUCA nog geen betekenisvolle ziekenhuisvergelijkingen op postoperatieve mortaliteit worden weergegeven. Een adequate casemixcorrectie met een laag aantal ‘events’ is niet mogelijk. Om deze reden is gekozen voor de uitkomst ‘gecompliceerd postoperatief beloop’ (zie kader DEFINITIES in hoofdstuk 2). Bij patiënten met een slokdarmcarcinoom die geregistreerd zijn in de DUCA is een gecompliceerd postoperatief beloop geassocieerd met pulmonale co-morbiditeit, diabetes mellitus, een ASA score van III of hoger, en het gebruik van immunosuppressiva (zie hoofdstuk 3 “Casemix”). In de groep patiënten met een maagcarcinoom is alleen een hogere leeftijd significant van invloed op deze ongunstige uitkomstmaat in multivariate analyse.
Ziekenhuizen verschillen in zorgzwaarte van de patiëntengroep (casemix). Het percentage patiënten met een gecompliceerd beloop vóór en na casemixcorrectie verschilt echter voor de meeste ziekenhuizen niet veel (figuur 3a en 3b). Voor enkele ziekenhuizen lijkt dit verschil wel aanzienlijk en daarom relevant.
Het casemix-correctiemodel heeft nog zijn beperkingen. Op termijn kan met meer patiënten in de DUCA dataset met grotere betrouwbaarheid voor casemix worden gecorrigeerd, en is ook voor de uitkomst ‘postoperatieve mortaliteit’ een casemixmodel te maken. De huidige casemix-gecorrigeerde ziekenhuisvergelijkingen kunnen wel waardevolle spiegelinformatie geven aan de deelnemende ziekenhuizen en zo bijdragen aan een interne kwaliteitsverbetering.
Pathologie
Een volledige registratie van pathologische parameters is essentieel voor een uitkomstregistratie als de DUCA. Veel variabelen betreffende het pathologisch onderzoek worden goed geregistreerd, maar het percentage patiënten bij wie alle pathologische gegevens bekend zijn in de DUCA is laag (19% van de patiënten met een slokdarmcarcinoom en 24% van de patiënten met een maagcarcinoom; zie hoofdstuk 5 “Pathologie”). Met name de afstand van de tumor tot de proximale en distale snijranden en, bij het slokdarmcarcinoom, de circumferentiële resectiemarge (CRM) ontbreken vaak (> 40%). De CRM is tumorpositief bij 11% van de patiënten met een slokdarmcarcinoom bij wie de CRM is ingevuld.
De lymfeklieropbrengst is ten opzichte van 2011 duidelijk toegenomen. Er wordt wel een aanzienlijke spreiding tussen de ziekenhuizen gezien. Verschillen in de verdeling van transthoracale versus transhiatale slokdarmresecties en van totale versus partiële maagresecties zijn mogelijk van invloed. Een actieve participatie van pathologen in de registratie in combinatie met een gestandaardiseerde verslaglegging in PALGA (slokdarm-maag module) kunnen bijdragen aan een kwaliteitsslag op het gebied van het pathologisch onderzoek van het (gereseceerde) slokdarm- en maagcarcinoom.
Afsluiting
Het tweede DUCA registratiejaar is met succes afgerond. Het aantal ingevoerde patiënten is meer dan verdubbeld, de landelijke dekking is hoog en de toewijding van de deelnemers om de individuele patiëntgegevens volledig in te vullen is groot. De voornaamste uitdaging voor de toekomst is het verder in kaart brengen van de betrouwbaarheid van de ingevoerde gegevens. Alleen met betrouwbare uitkomstinformatie kunnen zorgprocessen geïdentificeerd worden die het predikaat ‘best practices’ verdienen. Een minstens zo belangrijke uitdaging is - nog steeds - de betrokkenheid van andere disciplines. Een registratie van alleen geopereerde patiënten met een slokdarm- of maagcarcinoom mist informatie over onder andere resectiepercentages, toxiciteit van (neo-)adjuvante therapie, en uitkomsten van niet-chirurgische behandelingen. In 2013 zullen naar verwachting belangrijke stappen gezet worden die nodig zijn voor een betrouwbare, multidisciplinaire Dutch Upper GI Cancer Audit.
Volledigheid en betrouwbaarheid
Summary Samenvatting
- De volledigheid op landelijk niveau van de DUCA is in 2012 toegenomen ten opzichte van het eerste registratiejaar 2011 naar 91 procent van het totaal aantal slokdarmkankerresecties en naar 82 procent van het totaal aantal maagkankerresecties op basis van de aantallen in de Nederlandse Kankerregistratie (NKR) van 2011. In de DUCA dataset van 2012 zijn gegevens ingevoerd van 1210 patiënten die geopereerd werden vanwege een slokdarmcarcinoom (n =739) of maagcarcinoom (n =471).
- In dit tweede registratiejaar van de DUCA participeerden 42 ziekenhuizen, waaronder enkele nieuwe deelnemers alsook enkele ziekenhuizen die stopten met de DUCA registratie in 2012.
- De volledigheid van de ingevulde items per individuele patiënt in de DUCA 2012 was hoog.
- De geregistreerde patiënten in de DUCA lijken voor wat betreft een aantal patiëntkenmerken representatief voor alle patiënten die een slokdarm- of maagkankerresectie ondergaan (op basis van NKR gegevens). In de DUCA registratie heeft dus geen noemenswaardige selectie van specifieke groepen patiënten plaatsgevonden.
- Er zijn discrepanties tussen de gegevens van de NKR 2011 en de DUCA 2011, zowel ten aanzien van de aantallen patiënten alsook ten aanzien van een aantal uitkomsten, zowel op landelijk als op ziekenhuisniveau. In de DUCA zijn de aantallen patiënten per ziekenhuis soms hoger en soms lager dan die in de NKR in 2011. Deze opmerkelijke discrepanties in patiënten aantallen zijn een reden voor nader onderzoek op patiëntniveau.
- De uitkomstparameter 30-dagen mortaliteit komt voor patiënten met een slokdarmcarcinoom op landelijk niveau en op ziekenhuisniveau matig overeen tussen de NKR en de DUCA in het eerste registratiejaar 2011. Voor patiënten met een maagcarcinoom komt de 30-dagen mortaliteit redelijk overeen tussen beide registraties. Validatie van de sterftecijfers op ziekenhuisniveau lijkt essentieel.
- Voor wat betreft de pathologische parameters “radicaliteit van de resectie” en “percentage patiënten bij wie 10 of meer lymfeklieren zijn onderzocht” bestaat een redelijke overeenstemming op landelijk niveau en op ziekenhuisniveau tussen de NKR en de DUCA in 2011.
- Bij 96 procent van de geregistreerde patiënten in de DUCA in 2012 zijn de vijf minimaal vereiste items om in aanmerking te komen voor analyse ingevuld. Dit betreft 697 patiënten met een slokdarmcarcinoom en 465patiënten met een maagcarcinoom. Dit zijn de patiënten aantallen die in de volgende hoofdstukken gebruikt worden.
In 2011 is de Dutch Upper GI Cancer Audit (DUCA) van start gegaan. De DUCA is een landelijk registratiesysteem waarin de uitkomsten van zorg worden vastgelegd van patiënten die geopereerd worden vanwege een slokdarmcarcinoom, een slokdarm-maagovergangscarcinoom of een maagcarcinoom. Geïncludeerd worden patiënten met primaire tumoren, recidieftumoren en profylactische resecties (bijv. vanwege hooggradige dysplasie in een Barrett-slokdarm of in het kader van een CDH1-genmutatie). Patiënten met niet-epitheliale tumoren (bijv. Gastro-intestinale stromaceltumoren (GIST), sarcomen, melanomen) vallen niet binnen de inclusiecriteria, evenals patiënten bij wie geen resectie van de tumor gepland was (maar bijvoorbeeld alleen een bypass) en patiënten bij wie van het begin af aan gekozen is voor een niet-chirurgische behandeling (bijv. definitieve chemoradiotherapie). Dit jaar zijn de resultaten van het tweede registratiejaar van de DUCA bekend. Begin 2012 is de dataset met een beperkt aantal items uitgebreid ten opzichte van 2011 (Zie kader).
Nieuw geregistreerde items in DUCA 2012
- Is de patiënt verwezen uit een ander ziekenhuis? (ja/nee)
- Afstand (bij scopie) van de tandenrij tot de Z-lijn (in cm)
- Afstand (bij scopie) van de tandenrij tot het diafragma (in cm)
- Is voorafgaand aan de operatie een EMR (Endoscopische Mucosale Resectie) verricht?
- Profylactische resectie (ja/nee)
In het jaarrapport van 2011 werd beschreven dat de landelijke dekking van de DUCA nog niet volledig was1. Vooral bij het maagcarcinoom was er ruimte voor verbetering in volledigheid. In 2012 is hier via de beroepsverenigingen aandacht aan gegeven en zijn chirurgische vakgroepen nogmaals aangeschreven. Overigens is deelname aan de DUCA een kwaliteitseis in het normeringsdocument van de Samenwerkende Oncologische Specialismen (SONCOS) en van de Nederlandse Vereniging voor Heelkunde (NVvH)2.
In dit eerste hoofdstuk wordt gekeken in hoeverre de DUCA-registratie volledig en betrouwbaar is. Hiertoe worden de DUCA-gegevens vergeleken met die van de Nederlandse Kankerregistratie (NKR). De meest recente beschikbare gegevens uit de NKR zijn uit 2011. Om die reden worden in de meeste analyses in dit hoofdstuk de DUCA-gegevens uit 2011 betrokken. Er wordt onderscheid gemaakt tussen de volgende zaken:
- Volledigheid op patiëntniveau: zijn de DUCA-registratieformulieren volledig ingevuld?
- Volledigheid op landelijk niveau: werden alle resecties voor het slokdarm- of maagcarcinoom die in 2011 en 2012 in Nederland werden verricht, geregistreerd in de DUCA?
- Volledigheid op ziekenhuisniveau: hoe compleet was de registratie per ziekenhuis in de DUCA?
- Betrouwbaarheid op landelijk niveau: zijn de patiënten in de DUCA representatief voor alle patiënten in Nederland die een resectie ondergingen vanwege een slokdarm- of maagcarcinoom?
- Betrouwbaarheid op ziekenhuisniveau: zijn de uitkomsten in de DUCA voor ieder ziekenhuis hetzelfde als de uitkomsten in de NKR?
Volledigheid op patiëntniveau
Het aantal ingevulde items per patiënt in de DUCA is hoog, net als in het eerste registratiejaar. Om de gegevens van een ingevoerde patiënt in de DUCA te kunnen analyseren, moeten de volgende vijf items minimaal zijn ingevuld:
- geboortedatum
- de plaats van de tumor (slokdarm of maag)
- de operatiedatum
- de aard van de uitgevoerde ingreep (curatief, palliatief, profylactisch, geen resectie)
- overlevingsstatus (is de patiënt overleden tijdens de opname waarin de operatie plaatsvond of binnen 30 dagen na de operatie?)
In 2012 was 94% van het aantal patiënten met een slokdarmcarcinoom dat geregistreerd werd ook analyseerbaar . Met name de aard van de ingreep ontbrak bij de niet-analyseerbare patiënten. Van de geregistreerde patiënten met een maagcarcinoom was 99% analyseerbaar.
Bij de patiënten van wie de minimaal vereiste items volledig werden ingevuld, zijn de overige belangrijke items ook vrijwel compleet ingevuld. Zo is bij alle patiënten de comorbiditeit geregistreerd en zijn de items in het diagnostisch proces (CT-scan abdomen, CT-scan thorax, PET-CT) nagenoeg voor 100% ingevuld. Hetzelfde geldt voor de belangrijkste items aangaande de perioperatieve en chirurgische behandeling, inclusief de items voor het postoperatief beloop. Deze zijn allemaal voor 98 tot 100% compleet. Voor een aantal items betreffende het histopathologisch onderzoek van het resectiepreparaat ligt dit percentage lager, of is vaak “onbekend” ingevuld. Hierover vindt u meer in hoofdstuk 5 “Pathologie”.
Volledigheid op landelijk niveau
Bij afsluiting van de dataset op 1 februari 2013 hadden 42 ziekenhuizen zich aangemeld. Een jaar daarvoor participeerde eenzelfde aantal ziekenhuizen in de DUCA, maar het zijn niet exact dezelfde ziekenhuizen; in een aantal ziekenhuizen werd deelname aan de landelijke registratie niet voortgezet en in eenzelfde aantal ziekenhuizen werd deelname aan de DUCA in 2012 gestart. Vanuit alle 42 ziekenhuizen waren patiënten ingevoerd. In de hele dataset van 2012 zijn gegevens ingevoerd van in totaal 1.210 patiënten die vanwege een slokdarmcarcinoom (n =739) of maagcarcinoom (n =471) geopereerd werden in 2012. Bij twee patiënten was de plaats van de tumor niet gespecificeerd. Er is een grote variatie in het aantal ingevoerde patiënten per ziekenhuis. Figuur 1 toont het aantal analyseerbare patiënten dat in 2011 en in 2012 in de DUCA werd ingevoerd per registrerend ziekenhuis.
Vergelijking met de Nederlandse Kankerregistratie (NKR)
In dit hoofdstuk worden de gegevens van de DUCA uit 2011 en 2012 vergeleken met de NKR-gegevens uit het jaar 2011. De NKR-gegevens over 2012 zijn op het moment van schrijven van deze rapportage nog niet beschikbaar. De volledigheid van de DUCA in 2012 is een benadering vanwege een natuurlijke variatie in het aantal patiënten per jaar. Bovendien is er een landelijke trend in het aantal slokdarmkankerresecties (met jaarlijks een toename van ongeveer 5%), alsook in het aantal maagkankerresecties (met jaarlijks een afname van ongeveer 5%)3.
Om de data uit de DUCA te kunnen vergelijken met die uit de NKR, is een aantal selectiecriteria gehanteerd om te komen tot dezelfde patiëntenpopulatie: patiënten die een resectie ondergingen voor een primair slokdarm- of maagcarcinoom. De patiënten in de DUCA die geen resectie ondergingen (maar alleen een gastro-enterostomie of een open-dichtprocedure) of die geopereerd werden vanwege een recidiverende tumor zijn hier dus buiten beschouwing gelaten.
Slokdarmcarcinoom
De volledigheid op landelijk niveau is weergeven in tabel 1. Voor patiënten die een resectie ondergingen vanwege een primair slokdarmcarcinoom was er een redelijke landelijke dekking in het eerste DUCA registratiejaar, ondanks het feit dat er nog een relatief groot aantal ziekenhuizen niet participeerde. De ziekenhuizen van waaruit geen slokdarmkankerresecties werden geregistreerd, zijn gemiddeld genomen de ziekenhuizen met een lager aantal resecties (mediaan 1,5 resecties; spreiding 1-45) dan de ziekenhuizen die wel participeerden (mediaan 19 resecties). Vier van de zestien ziekenhuizen die geen slokdarmkankerresecties in de DUCA registreerden in 2011 deden dat wel in 2012. Wanneer de NKR-aantallen in 2011 als 100% worden beschouwd, blijkt de landelijke dekking van de DUCA in 2012 gestegen naar 91% van alle resecties die werden uitgevoerd vanwege een primair slokdarmcarcinoom.
| NKR 2011 | DUCA 2011 | DUCA 2012 | ||||
| aantal resecties | ||||||
| Slokdarmcarcinoom | 755 | 100% | 572 | 76% | 688 | 91% |
| Maagcarcinoom | 498 | 100% | 302 | 61% | 406 | 82% |
| aantal ziekenhuizen | ||||||
| Slokdarmcarcinoom | 37 | 100% | 21 | 57% | 25 | 68% |
| Maagcarcinoom | 76 | 100% | 36 | 47% | 42 | 55% |
Maagcarcinoom
De landelijke dekking van de DUCA voor wat betreft de maagkankerresecties was in 2011 lager dan voor de slokdarmkankerresecties (tabel 1). De ziekenhuizen van waaruit geen patiënten in de DUCA werden ingevoerd, zijn ook hier weer gemiddeld genomen de ziekenhuizen met een wat lager aantal resecties (mediaan 3,5 resecties; spreiding 1-36) dan de ziekenhuizen die wel in de DUCA participeerden (mediaan 8 resecties). Acht van de veertig ziekenhuizen die in 2011 geen maagkankerresecties registreerden in de DUCA deden dat wel in 2012. Nog sterker dan bij de slokdarmresecties is bij de resecties vanwege een primair maagcarcinoom een stijging te zien in de landelijke volledigheid: in 2012 was de landelijke dekking gestegen naar ongeveer 82%.
Het is de vraag waarom de volledigheid van de DUCA op landelijk niveau groter is voor patiënten met een slokdarmcarcinoom dan voor patiënten met een maagcarcinoom. Een mogelijke verklaring is dat operaties vanwege een slokdarmcarcinoom vooral worden uitgevoerd in gespecialiseerde centra, terwijl operaties vanwege een maagcarcinoom vooralsnog in vrijwel alle ziekenhuizen in Nederland plaatsvinden. In gespecialiseerde centra is de infrastructuur wellicht meer ingericht op deelname aan een landelijke registratie.
Volledigheid op ziekenhuisniveau in 2011
In een vergelijking op ziekenhuisniveau tussen DUCA 2011 en NKR 2011 komen de aantallen resecties vanwege een primair slokdarmcarcinoom slechts bij vier ziekenhuizen exact overeen en vanwege een primair maagcarcinoom bij zeventien ziekenhuizen. Er zijn zowel ziekenhuizen waar minder resecties in de DUCA zijn geregistreerd dan er volgens de NKR zijn uitgevoerd als ziekenhuizen waar minder in de NKR werd geregistreerd dan in de DUCA. Het verschil betreft meestal enkele patiënten, maar gezien de relatief lage aantallen per ziekenhuis zijn deze verschillen niet te verwaarlozen.
Het kan zijn dat ziekenhuizen in het eerste DUCA-registratiejaar wel gestart zijn met deelname aan de DUCA, maar dat zij nog geen volledige registratie gehaald hebben. Een klein deel van de verschillende aantallen betreft patiënten die in het buitenland wonen, die niet in de NKR maar wel in de DUCA geregistreerd worden. Bovenstaande opmerkelijke discrepanties in aantallen slokdarm- en maagkankerresecties geregistreerd in de NKR en in de DUCA zijn reden voor nader onderzoek op patiëntniveau om de waargenomen verschillen te kunnen verklaren.
Betrouwbaarheid op landelijk niveau in 2011
Patiëntkarakteristieken
Tabel 2 toont een aantal patiëntkarakteristieken en uitkomsten voor patiënten ingevoerd in de NKR 2011 en in de DUCA 2011. De patiëntkarakteristieken van de twee registraties komen vrij goed overeen, zowel voor de patiënten met een slokdarm- als voor patiënten met een maagcarcinoom. In de DUCA wordt het tumorstadium iets vaker als onbekend geregistreerd of niet ingevuld.
| Slokdarmcarcinoom | Maagcarcinoom | ||||
| NKR 2011 | DUCA 2011 | NKR 2011 | DUCA 2011 | ||
| n=755 | n=572 | n=498 | n=302 | ||
| Patientkarakteristieken | |||||
| Geslacht | Man | 78% | 78% | 64% | 66% |
| Vrouw | 22% | 22% | 36% | 34% | |
| Leeftijd | <61 | 33% | 32% | 25% | 26% |
| 61-70 | 40% | 40% | 23% | 22% | |
| 71-80 | 25% | 26% | 37% | 33% | |
| >80 | 2,0% | 3,0% | 15% | 19% | |
| pTNM7 | stadium 0* | 22% | 21% | 4,0% | 5,0% |
| stadium I | 26% | 25% | 25% | 24% | |
| stadium II | 21% | 19% | 32% | 31% | |
| stadium III | 27% | 24% | 33% | 24% | |
| stadium IV | 2,0% | 1,0% | 3,0% | 9,0% | |
| stadium onbekend/X | 2,0% | 10% | 3,0% | 8,0% | |
| Uitkomsten | |||||
| 30 dagen mortaliteit | 2,2% | 1,1% | 6,9% | 7,0% | |
| Radicaliteit resecties | R0 | 91% | 92% | 79% | 76% |
| R1 | 7% | 6% | 15% | 15% | |
| R2 | 1,0% | 0,0% | 3,0% | 3,0% | |
| onbekend | 1,0% | 2,0% | 2,0% | 6,0% | |
| mediaan aantal lymfeklieren | 14 | 15 | 13 | 14 | |
| 10 of meer lymfeklieren | 76% | 78% | 66% | 68% | |
Uitkomsten
In de DUCA werd in 2011 overlijden binnen 30 dagen na de operatie geregistreerd bij 1,1% van de patiënten die een resectie onderging in verband met primair slokdarmcarcinoom. Dit is een duidelijke onderrapportage ten opzichte van de NKR, waar 2,2 % 30-dagenmortaliteit werd geregistreerd. Overigens is de 30-dagenmortaliteit 32 % in de DUCA 2012. Wanneer de gegevens van de NKR over het jaar 2012 beschikbaar komen, zal blijken of de mortaliteitsregistratie in het tweede registratiejaar van de DUCA beter overeenkomt met de NKR dan in 2011. Bij het maagcarcinoom komt de 30-dagensterfte na resectie wel goed overeen tussen de twee registraties. Nadere validatie in de individuele ziekenhuizen zal moeten uitwijzen of de geregistreerde mortaliteit daadwerkelijk op patiëntniveau overeenkomt.
Voor wat betreft een geselecteerd aantal uitkomsten van het pathologisch onderzoek is er goede overeenkomst op landelijk niveau tussen de DUCA en de NKR in 2011.
Betrouwbaarheid op ziekenhuisniveau in 2011
Bovengenoemde kwaliteitsparameters zijn ook per ziekenhuis vergeleken tussen de NKR en de DUCA over het jaar 2011. Bij de interpretatie van deze analyses op ziekenhuisniveau is het belangrijk om het volgende in gedachten te houden. De verschillen in het aantal geregistreerde patiënten per ziekenhuis tussen NKR en DUCA zijn van invloed op de gerapporteerde kwaliteitsparameters. Bovendien is het aantal patiënten per ziekenhuis vaak laag, met name bij het maagcarcinoom, waardoor een klein verschil in absolute aantallen groot lijkt wanneer dit is uitgedrukt in percentages. Toch is er gekozen voor een weergave van percentages om de privacy van individuele ziekenhuizen te waarborgen.
In een vergelijking op ziekenhuisniveau blijkt vaak sprake van een verschil in de gerapporteerde 30-dagenmortaliteit tussen de twee registraties. Daarbij is de sterfte na resectie vanwege een slokdarmcarcinoom op basis van de DUCA-gegevens steeds lager dan die op basis van de NKR-gegevens. De 30-dagenmortaliteit na resectie vanwege een maagcarcinoom komt redelijk overeen tussen beide registraties. Bij afwijkingen zijn er zowel ziekenhuizen met een hogere sterfte in de DUCA dan in de NKR alsook ziekenhuizen met een lagere sterfte in de DUCA dan in de NKR.
Ook het percentage R0-resecties is per ziekenhuis vergeleken en komt voor patiënten met een slokdarmcarcinoom redelijk goed overeen tussen beide registraties. Bij het maagcarcinoom is er een matige overeenstemming, met verschillen in beide richtingen.
In de figuren 2a en 2b zijn de resultaten weergegeven van de vergelijking op de kwaliteitsparameter ‘percentage patiënten bij wie minimaal 10 lymfeklieren zijn onderzocht’. Bij het slokdarmcarcinoom komt deze kwaliteitsparameter redelijk overeen tussen beide registraties. Verschillen in de percentages tussen de DUCA en NKR gaan beide kanten op. Ook bij het maagcarcinoom bestaat redelijke overeenstemming. Er is iets vaker sprake van een hoger percentage in de DUCA dan in de NKR, dan andersom. Mogelijk speelt enige onderregistratie van patiënten met een klein aantal lymfeklieren in de DUCA hierbij een rol. De verschillende percentages kunnen ook voortkomen uit een verschil in interpretatie van het PA-verslag. Dit laatste wordt ondervangen wanneer een gestandaardiseerde slokdarm-maagmodule voor de PA-verslaglegging zijn intrede doet 4 .
Referenties
1.Resultaten en kwaliteitsparameters
Summary Samenvatting
- Bij het merendeel van de patiënten met een slokdarm- of maagcarcinoom wordt de diagnostiek volgens de landelijke richtlijnen toegepast. Tussen 2011 en 2012 is een duidelijke toename te zien in de toepassing van PET-CT bij patiënten met een klinisch T3 slokdarmcarcinoom (van 52% naar 73%). Bij patiënten met een maagcarcinoom is ondanks de adequate invulling van het diagnostisch proces het klinisch TNM stadium bij bijna de helft van de patiënten onbekend.
- De wachttijden tussen datum van diagnose en start van de behandeling zijn in beide patiëntengroepen onveranderd lang (mediaan 6 weken in de groep patiënten met een slokdarmcarcinoom en mediaan 5 weken in de groep patiënten met een maagcarcinoom).
- In de chirurgische behandeling van het slokdarmcarcinoom is het percentage patiënten dat een resectie ondergaat via een transthoracale (i.p.v. transhiatale) benadering toegenomen (van 45% naar 55%). Daarnaast is ook het percentage patiënten met een slokdarmcarcinoom dat minimaal invasief geopereerd wordt iets toegenomen (van 37% naar 41%), terwijl de overgrote meerderheid van patiënten met een maagcarcinoom via een open benadering geopereerd wordt (93%).
- Evenals in 2011 is het percentage patiënten met een gecompliceerd postoperatief beloop hoger in de groep patiënten met een slokdarmcarcinoom (32%) dan in de groep patiënten met een maagcarcinoom (23%).
- De postoperatieve mortaliteit (binnen 30-dagen en/of in-het-ziekenhuis) voor patiënten met een slokdarmcarcinoom was hetzelfde als in 2011 (4,4 procent). Voor patiënten met een maagcarcinoom werd een lagere postoperatieve mortaliteit geregistreerd in 2012 dan in 2011, maar deze is met 6,7 procent nog steeds hoog. De sterfte na een operatie vanwege maagkanker treedt met name op bij patiënten die een palliatieve resectie of alleen een exploratieve laparotomie ondergaan.
In de DUCA-database worden gegevens ingevoerd van chirurgische patiënten met een slokdarm- of maagcarcinoom. Behalve patiënt- en tumorkarakteristieken bevat de database gegevens over het zorgproces van diagnostiek en behandeling. In dit hoofdstuk worden de basale cijfers van dit proces gepresenteerd. Hierbij worden de gegevens voor het slokdarm- en maagcarcinoom grotendeels apart weergegeven, uitgesplitst voor 2011 en 2012.
Aantal analyseerbare patiënten
Het jaar 2012 is het tweede registratiejaar van de DUCA. Het aantal patiënten per ziekenhuis varieerde sterk (zie figuur 1 in hoofdstuk 1 'Volledigheid en Betrouwbaarheid”). In de dataset van 2012 zijn gegevens ingevoerd van in totaal 1.210 patiënten die vanwege een slokdarmcarcinoom (n =739) of maagcarcinoom (n =471) geopereerd werden. Bij twee patiënten was de plaats van de tumor niet gespecificeerd. Niet alle ingevoerde patiënten zijn analyseerbaar: er geldt een minimale gegevensinvoer om een patiënt mee te kunnen nemen in de analyses. De vijf minimaal vereiste items staan vermeld in het hoofdstuk “Volledigheid en Betrouwbaarheid”. De resultaten van de DUCA 2012 zijn gebaseerd op 1.162 analyseerbare patiënten. Het betreft 697 patiënten met een slokdarmcarcinoom en 465 patiënten met een maagcarcinoom. Ter vergelijking: het aantal analyseerbare patiënten in de DUCA dataset van 2011 bedroeg 607 patiënten met een slokdarmcarcinoom en 331 patiënten met een maagcarcinoom.
Patiënt- en tumorkarakteristieken
In tabel 1 ziet u de patiëntkenmerken van de analyseerbare patiënten in de DUCA. Evenals in 2011 zijn patiënten die geopereerd worden vanwege een maagcarcinoom gemiddeld ouder dan patiënten die geopereerd worden vanwege een slokdarmcarcinoom. Als maat voor de gezondheidstoestand van de patiënt is o.a. de Charlson Comorbidity Index (zie kader Definities) gebruikt. Het percentage patiënten met een Charlsonscore van ten minste twee is in de groep patiënten die geopereerd wordt vanwege een maagcarcinoom iets gestegen (van 28 naar 33%). Hiermee is het verschil in comorbiditeit ten opzichte van de groep patiënten die geopereerd wordt vanwege een slokdarmcarcinoom (24% Charlson 2+) nog groter geworden. Daarentegen heeft bijna een op de vijf patiënten die geopereerd wordt vanwege een slokdarmcarcinoom overgewicht (BMI > 30) versus een op de acht patiënten die geopereerd wordt vanwege een maagcarcinoom. Ondergewicht (BMI < 20) is geregistreerd bij 11% van de patiënten die geopereerd wordt vanwege een maagcarcinoom en bij 7,5% van de patiënten die geopereerd wordt vanwege een slokdarmcarcinoom. Het DUCA-invulformulier is begin 2013 uitgebreid met het item “is patiënt voorafgaand aan deze operatie begeleid door een diëtist?” om te analyseren of dit eveneens volgens de norm gebeurt.
| Slokdarmcarcinoom | Maagcarcinoom | |||
| 2011 | 2012 | 2011 | 2012 | |
| n=607 | n=697 | n=331 | n=465 | |
| % | % | % | % | |
| Patientkenmerken | ||||
| mannelijk geslacht | 77% | 76% | 65% | 57% |
| gemiddelde leeftijd in jaren | 65 | 64 | 68 | 68 |
| leeftijd > 70 jaar | 29% | 25% | 52% | 48% |
| gemiddelde BMI | 26 | 26 | 25 | 25 |
| ondergewicht (BMI <20) | 7,5% | 7,5% | 10% | 11% |
| overgewicht (BMI >30) | 16% | 19% | 13% | 12% |
| ASA III of meer | 21% | 23% | 25% | 36% |
| Charlson 2 of meer* | 24% | 24% | 28% | 33% |
| Diagnostiek | ||||
| Echo/CT hals | 93% | 82% | 25% | 28% |
| CT thorax | 99% | 95% | 85% | 92% |
| CT abdomen | 99% | 95% | 94% | 97% |
| PET-CT | 52% | 68% | 19% | 18% |
| PET-CT bij cT3 slokdarmtumor** | 52% | 73% | . | . |
| EUS | 90% | 85% | 23% | 23% |
| EUS met punctie | 19% | 14% | 4,5% | 4,5% |
| Diagnostische laparoscopie | 1,7% | 1,1% | 7,9% | 6,0% |
| Klinisch stadium | ||||
| 0 | . | 0,9% | 2,4% | 1,5% |
| I | 13% | 13% | 18% | 11% |
| II | 22% | 23% | 33% | 30% |
| III | 56% | 52% | 6,0% | 7,3% |
| IV | 1,0% | 0,6% | 4,0% | 2,6% |
| X/onbekend | 8,4% | 11% | 38% | 48% |
Bij het item ‘Nadere plaatsbepaling van de tumor’ in de DUCA-registratie is uitgegaan van de 7de editie van de TNM classificatie1. Naar analogie van deze classificatie worden ook in de DUCA de tumoren op de slokdarm-maagovergang gerubriceerd onder ‘Slokdarm’. In het vorige jaarrapport is in een apart hoofdstuk ingegaan op de dilemma’s omtrent diagnostiek en behandeling van de slokdarm-maagovergangstumoren. Figuur 1 toont de verdeling van het aantal analyseerbare patiënten in de DUCA naar plaats van de tumor in slokdarm of maag. Vande patiënten die geopereerd zijn vanwege een slokdarmcarcinoom heeft het merendeel een adenocarcinoom (79%) en een minderheid een plaveiselcelcarcinoom (18%) of ‘anders’ (bijna 3%). Alle patiënten met een maagcarcinoom in de DUCA hebben een adenocarcinoom.
DEFINITIES
-
Charlson Comorbidity Index:
Bij deze comorbiditeitsscore wordt aan iedere comorbiditeit een gewogen score toegekend, gebaseerd op het relatieve risico op sterfte na 1 jaar. -
Postoperatieve sterfte:
Het overlijden van de patiënt binnen 30 dagen na de operatie en/of tijdens dezelfde ziekenhuisopname. -
Gecompliceerd postoperatief beloop:
Een gecompliceerd postoperatief beloop is een samengestelde parameter voor complicaties waaraan de patiënt overleden is óf waar een reïnterventie voor heeft plaatsgevonden óf waarbij de opnameduur is verlengd tot meer dan 21 dagen.
Diagnostisch proces en klinische stadiëring
Gegevens uit het diagnostisch proces staan eveneens vermeld in tabel 1.
De diagnostiek vindt grotendeels plaats conform de landelijke richtlijnen2. Er is een enkele verschuiving tussen 2011 en 2012 waarneembaar. Het gebruik van de PET-CT bij patiënten met een (klinisch T3) slokdarmcarcinoom is toegenomen. Daarentegen werd bij minder patiënten apart beeldvormend onderzoek van de hals verricht. In het diagnostisch proces bij patiënten met een maagcarcinoom zijn geen opvallende veranderingen te zien, behalve een lichte toename van het percentage patiënten bij wie een CT-thorax is verricht. Een diagnostische laparoscopie wordt niet vaak verricht.
Bij de stadiëring van het slokdarm- en maagcarcinoom wordt gebruik gemaakt van de TNM-classificatie, 7de editie1. Zoals in het eerste DUCA-registratiejaar is wederom te zien dat ruim de helft van de patiënten die geopereerd wordt vanwege een slokdarmcarcinoom een klinisch stadium III heeft (52%). Bij de patiënten die geopereerd worden vanwege een maagcarcinoom lijkt het klinisch stadium gunstiger (30% stadium II), maar bij bijna de helft van de patiënten met een maagcarcinoom is het klinisch tumorstadium onbekend (48%). Dit hoge percentage is goed te verklaren vanuit de beperkingen van het CT-onderzoek om het T-stadium (de mate van tumoringroei in de maagwand) en N-stadium (aantal tumorpositieve lymfeklieren) vast te stellen. Het gevolg is dat een vergelijking van resultaten gecorrigeerd voor het klinisch tumorstadium vrijwel onmogelijk is.
Behandeling
In tabel 2 zijn de behandelingskarakteristieken weergegeven van de analyseerbare patiënten met een slokdarm- of maagcarcinoom. Wat betreft de toepassing van preoperatieve therapie is het beeld voor 2012 onveranderd vergeleken met 2011. Voor het slokdarmcarcinoom geldt dat 89% van de patiënten wordt voorbehandeld. Bij het maagcarcinoom is het percentage patiënten dat voorbehandeld wordt aanzienlijk lager (55%). Inzicht in de argumenten om patiënten wel of niet voor te behandelen, vraagt om een multidisciplinaire audit. Meer over dit onderwerp is te lezen in hoofdstuk 4 “(Neo-)adjuvante therapie”.
| Slokdarmcarcinoom | Maagcarcinoom | |||
| 2011 | 2012 | 2011 | 2012 | |
| % | % | % | % | |
| Preoperatieve therapie ^ | ||||
| wel preoperatieve therapie | 91% | 89% | 55% | 55% |
| chemotherapie | 16% | 14% | 53% | 51% |
| chemoradiotherapie | 74% | 75% | 1,3% | 1,7% |
| Operatie | n=607 | n=697 | n=331 | n=465 |
| Type operatie | ||||
| THOCR | 48% | 38% | 1,2% | 0,2% |
| TTOCR | 45% | 55% | 0,3% | 0,9% |
| totale maagresectie | 1,0% | 2,2% | 36% | 33% |
| partiële maagresectie | 0,3% | 0,4% | 55% | 54% |
| geen resectie | 5,8% | 4,3% | 7,0% | 12% |
| Benadering | ||||
| open | 63% | 59% | 92% | 93% |
| minimaal invasief | 37% | 41% | 8,2% | 6,7% |
| Aanvullende resectie | ||||
| ja | 3% | 4% | 9% | 13% |
| Type reconstructie* | n=577 | n=662 | n=306 | n=414 |
| geen | . | 0,5% | 3,3% | 2,4% |
| buismaag | 98% | 97% | 2,6% | 1,9% |
| coloninterponaat | 1,0% | 0,3% | . | . |
| jejunuminterponaat | . | 0,2% | 3,9% | 5,6% |
| oesophagojejunostomie | 0,7% | 1,8% | 34% | 44% |
| gastroenterostomie | 0,3% | 0,2% | 55% | 45% |
| Ligging anastomose* | ||||
| geen anastomose | 0,2% | . | 1,4% | 1,5% |
| hals | 88% | 80% | 0,7% | 0,2% |
| intrathoracaal | 10% | 18% | 3,4% | 5,5% |
| intra-abdominaal | 1,1% | 2,0% | 94% | 91% |
| Postoperatieve therapie** | n=577 | n=659 | n=279 | n=374 |
| wel postoperatieve therapie | 5,2% | 5,8% | 36% | 38% |
| chemotherapie | 5,0% | 4,7% | 31% | 27% |
| chemoradiotherapie | . | 1,1% | 5,4% | 8,8% |
| radiotherapie | 0,2% | . | . | . |
Bij de operatiegegevens valt op dat het percentage patiënten met een slokdarmcarcinoom dat een transthoracale resectie – in tegenstelling tot een transhiatale resectie – ondergaat, toegenomen is van 45% naar 55%. Er is een lichte toename in het aandeel minimaal invasieve slokdarmresecties, terwijl het overgrote merendeel van de maagresecties als een open procedure wordt uitgevoerd (93%).
Postoperatief krijgt een klein deel van de patiënten met een slokdarmcarcinoom aanvullende therapie (5,8%). In de groep patiënten die geopereerd wordt vanwege een maagcarcinoom onderging 38% een aanvullende behandeling: 27% met chemotherapie en 8,8% met chemoradiotherapie; dit is hoger dan in 2011. Een verklaring hiervoor kan zijn een hoger aantal patiënten dat deelneemt aan de CRITICS-studie. Het percentage R1-resecties is afgenomen (zie tabel 4b) dus dit is niet de oorzaak van meer chemoradiotherapie in de adjuvante setting.
Uitkomstparameters
In tabel 3 zijn de belangrijkste klinische uitkomstparameters samengevat. De mediane opnameduur was in 2012 voor beide patiëntengroepen een dag korter dan in 2011. De percentages complicaties, reïnterventies en reoperaties zijn min of meer onveranderd. Een gecompliceerd postoperatief beloop (zie kader Definities) treedt op bij 32% van de patiënten na een slokdarmresectie en bij 23% van de patiënten na een maagresectie, terwijl - net zoals in 2011 - de postoperatieve sterfte juist lager is na een resectie vanwege een slokdarmcarcinoom (4,4%) dan na een resectie vanwege een maagcarcinoom (6,3%).
| Slokdarmcarcinoom | Maagcarcinoom | |||
| 2011 | 2012 | 2011 | 2012 | |
| % | % | % | % | |
| Klinische uitkomstparameters | n=577 | n=662 | n=306 | n=414 |
| opnameduur (mediaan) | 13 | 12 | 11 | 10 |
| postoperatieve complicaties | 57% | 60% | 36% | 38% |
| gecompliceerd beloop* | 36% | 32% | 20% | 23% |
| re-interventie | 20% | 20% | 15% | 15% |
| reoperatie | 15% | 13% | 12% | 13% |
| heropname op IC | 22% | 20% | 11% | 7% |
| aantal dagen op IC (mediaan) | . | 2 | . | 1 |
| heropname binnen 30 dagen | 13% | 12% | 11% | 9% |
| 30-dagen en/of in-ziekenhuismortaliteit | 4,5% | 4,4% | 8,8% | 6,3% |
| 30-dagen mortaliteit | 1,4% | 3,2% | 6,5% | 5,8% |
| in-ziekenhuismortaliteit | 3,3% | 2,4% | 5,2% | 5,3% |
De pathologische uitkomstparameters komen aan bod in hoofdstuk 5 “Pathologie”.
Totstandkoming van de DUCA-kwaliteitsparameters
De kwaliteitsparameters in deze audit zijn vastgesteld door de wetenschappelijke commissie van de DUCA waarin alle betrokken beroepsverenigingen zijn vertegenwoordigd. Ze zijn bedoeld om het zorgproces voor patiënten die geopereerd worden vanwege een slokdarm- of maagcarcinoom in Nederland zo compleet mogelijk in kaart te brengen3,4. De zorg voor patiënten met een slokdarm- of maagcarcinoom vereist een multidisciplinaire benadering. Voor beide aandoeningen zijn landelijke “evidence-based” richtlijnen ontwikkeld2. Deze richtlijnen bevatten aanbevelingen en adviezen over verwijzing, diagnostiek, behandeling en nazorg. Naleving van de richtlijnen is alleen bij benadering te registreren.
De DUCA-kwaliteitsparameters omvatten zowel procesindicatoren (zoals wachttijden en multidisciplinair overleg) alsook uitkomstmaten (zoals postoperatieve mortaliteit en lymfklieropbrengst). Waar mogelijk zijn de indicatoren verwerkt die door Zichtbare Zorg Ziekenhuizen (ZZZ) ontwikkeld zijn voor het maagcarcinoom in de DUCA-kwaliteitsparameters. Echter, een aantal ZZZ-indicatoren betreft allepatiënten met een maagcarcinoom en niet alleen de geopereerdepatiënten5. Daarnaast is ook op de behandeling van het slokdarm-maagcarcinoom de zogenaamde Treeknorm van toepassing6. Deze stelt dat ten minste 80% van de patiënten binnen vijf weken na de diagnose behandeld dient te worden, en 100% binnen zeven weken. Hierbij wordt geen rekening gehouden met een eventuele verwijzing naar een derdelijns ziekenhuis.
DUCA kwaliteitsparameters 2012
De DUCA-kwaliteitsparameters zoals gemeten in 2012 zijn weergegeven - naast de gegevens van 2011 - in tabel 4a voor het slokdarmcarcinoom en in tabel 4b voor het maagcarcinoom. In de hiernavolgende alinea’s wordt op een aantal hiervan nader ingegaan.
| Slokdarmcarcinoom | |||||||
| 2011 | 2012 | ||||||
| Kwaliteitsparameters DUCA | teller | noemer | % | teller | noemer | % | |
| Diagnostiek | Wachttijd diagnose-behandeling (mediaan, weken) | 6 | 6 | ||||
| % patienten met wachttijd < 5 weken | 186 | 607 | 31% | 217 | 697 | 31% | |
| % patienten preoperatief MDO | 593 | 607 | 98% | 673 | 697 | 97% | |
| Voorbehandeling | % patienten met voorbehandeling | 549 | 606 | 91% | 611 | 688 | 89% |
| (bij wie in-opzet-curatieve resectie is gepland) | |||||||
| Operatie | % minimaal invasieve resecties | 216 | 577 | 37% | 278 | 665 | 42% |
| % transthoracale slokdarmresecties | 270 | 569 | 48% | 385 | 649 | 59% | |
| Postoperatief | Naadlekkages na resectie | 110 | 577 | 19% | 123 | 665 | 19% |
| 30-dagen en/of in-ziekenhuissterfte | 27 | 607 | 4,4% | 31 | 697 | 4,4% | |
| 30-dagen sterfte | |||||||
| totaal | 9 | 607 | 1,5% | 22 | 697 | 3,2% | |
| na in-opzet-curatieve resectie | 8 | 577 | 1,4% | 21 | 659 | 3,2% | |
| na palliatieve resectie | 0 | 0 | . | 0 | 3 | 0,0% | |
| na geen resectie | 1 | 30 | 3,3% | 1 | 32 | 3% | |
| na profylactische resectie | 0 | 0 | . | 0 | 3 | 0% | |
| In-ziekenhuissterfte | |||||||
| totaal | 20 | 607 | 3,3% | 17 | 697 | 2,4% | |
| na in-opzet-curatieve resectie | 19 | 577 | 3,3% | 16 | 659 | 2,4% | |
| na palliatieve resectie | 0 | 0 | . | 0 | 3 | 0,0% | |
| na geen resectie | 1 | 30 | 3,3% | 1 | 32 | 3,1% | |
| na profylactische resectie | 0 | 0 | . | 0 | 3 | 0,0% | |
| Postoperatief MDO | 557 | 607 | 92% | 648 | 697 | 93% | |
| Pathologie | % R0 resecties | ||||||
| bij primaire tumor | 519 | 568 | 91% | 583 | 644 | 91% | |
| bij recidief tumor | 6 | 7 | 86% | 8 | 9 | 89% | |
| Mediaan aantal lymfeklieren | 15 | 17 | |||||
| % 10 of meer lymfeklieren | 445 | 568 | 78% | 540 | 644 | 84% | |
| % 15 of meer lymfeklieren | 300 | 568 | 53% | 387 | 644 | 60% | |
| Maagcarcinoom | |||||||
| 2011 | 2012 | ||||||
| Kwaliteitsparameters DUCA | teller | noemer | % | teller | noemer | % | |
| Diagnostiek | Wachttijd diagnose-behandeling (mediaan, weken) | 5 | 5 | ||||
| % patienten met wachttijd < 5 weken | 160 | 331 | 48% | 196 | 465 | 42% | |
| % patienten preoperatief MDO | 303 | 331 | 92% | 441 | 465 | 95% | |
| Voorbehandeling | % patienten met voorbehandeling(bij wie in-opzet-curatieve resectie is gepland) | 169 | 306 | 55% | 231 | 417 | 55% |
| Operatie | % minimaal invasieve resecties | 25 | 306 | 8,2% | 25 | 415 | 6,0% |
| Postoperatief | Naadlekkages na resectie | 11 | 306 | 3,6% | 34 | 415 | 8,2% |
| 30-dagen en/of in-ziekenhuisterfte | 29 | 331 | 8,8% | 31 | 465 | 6,7% | |
| 30-dagen mortaliteit | |||||||
| totaal | 22 | 331 | 6,6% | 29 | 465 | 6,2% | |
| na in-opzet-curatieve resectie | 16 | 279 | 5,7% | 17 | 374 | 4,5% | |
| na palliatieve resectie | 4 | 27 | 15% | 7 | 40 | 18% | |
| na geen resectie | 2 | 25 | 8,0% | 5 | 50 | 10% | |
| na profylactische resectie | 0 | 0 | . | 0 | 1 | 0,0% | |
| In-ziekenhuismortaliteit | |||||||
| totaal | 17 | 331 | 5,1% | 25 | 465 | 5,4% | |
| na in-opzet-curatieve resectie | 15 | 279 | 5,4% | 16 | 374 | 4,3% | |
| na palliatieve resectie | 1 | 27 | 3,7% | 6 | 40 | 15% | |
| na geen resectie | 1 | 25 | 4,0% | 3 | 50 | 6,0% | |
| na profylactische resectie | 0 | 0 | . | 0 | 1 | 0,0% | |
| Postoperatief MDO | 309 | 331 | 93% | 438 | 465 | 94% | |
| Pathologie | % R0 resecties | ||||||
| bij primaire tumor | 226 | 274 | 83% | 330 | 371 | 89% | |
| bij recidief tumor | 2 | 3 | 67% | 1 | 3 | 33% | |
| Mediaan aantal lymfeklieren | 14 | 18 | |||||
| % 10 of meer lymfeklieren | 192 | 274 | 70% | 305 | 371 | 82% | |
| % 15 of meer lymfeklieren | 129 | 274 | 47% | 235 | 371 | 63% | |
Wachttijd tot start behandeling
De Treeknorm (start behandeling binnen vijf weken na diagnose) wordt bij patiënten met een slokdarmcarcinoom slechts in 31% van de patiënten gehaald. Bij patiënten met een maagcarcinoom is dit in 42% het geval. Behalve deze relatief lage percentages op patiëntniveau is er op ziekenhuisniveau een opvallend forse spreiding in het behalen van de Treeknorm (figuur 2). De tijd tussen de diagnose en start van de behandeling is de resultante van de lengte van het diagnostisch traject, de toegangstijd tot het eerste polikliniekbezoek in het ziekenhuis van behandeling en de logistiek voorafgaand aan de preoperatieve behandeling.
In 2012 is het DUCA invulformulier uitgebreid met de vraag “Is de patiënt verwezen uit een ander ziekenhuis?”. Uit deze gegevens blijkt dat 69% van de patiënten met een slokdarmcarcinoom verwezen is en dat er geen verschil is in mediane wachttijd tot de start van de behandeling tussen wel of niet verwezen patiënten (zes weken in beide subgroepen). Daarentegen is in de groep patiënten met een maagcarcinoom 48% van de patiënten verwezen en is de mediane wachttijd tot de start van de behandeling zeven weken voor verwezen patiënten en vijf weken voor niet-verwezen patiënten.
Aangezien 89% van de patiënten met een slokdarmcarcinoom wordt voorbehandeld, gaat het in deze groep patiënten vooral om de tijd tussen diagnose en start van de preoperatieve behandeling (meestal chemoradiotherapie). In de groep patiënten met een maagcarcinoom is de dag van de operatie vaker de startdatum van de behandeling, waarbij – vooral in deze patiëntengroep - het in kaart brengen van de operabiliteit tijd in beslag kan nemen.
Preoperatieve behandeling
wezenlijke verschillen tussen het eerste en tweede DUCA-registratiejaar: 91% in 2011 en 89% in 2012 in de groep patiënten met een slokdarmcarcinoom. In de groep patiënten met een maagcarcinoom is het exact gelijk gebleven met 55% voorbehandeling in beide registratiejaren.
Postoperatieve sterfte
De geregistreerde gecombineerde postoperatieve sterfte (30-dagen en/of in-ziekenhuis) voor patiënten met een slokdarmcarcinoom was in 2012 hetzelfde als in 2011 (4,4%). Voor patiënten met een maagcarcinoom is deze afgenomen, maar nog altijd hoog (van 8,8% in 2011 naar 6,7% in 2012). Gezien het percentage patiënten met een gecompliceerd postoperatief beloop in de twee groepen (tabel 3), is het blijkbaar zo dat een postoperatieve complicatie bij patiënten met een maagcarcinoom vaker tot overlijden leidt dan bij patiënten met een slokdarmcarcinoom. De meest voor de hand liggende verklaring is het verschil in leeftijd en comorbiditeit. Anderszins zijn ervaring, infrastructuur en/of volume mogelijk van invloed op de uitkomst van de behandeling van postoperatieve complicaties.
De 30-dagenmortaliteit is in de groep patiënten met een slokdarmcarcinoom toegenomen van 1,5% naar 3,2%, terwijl de in-ziekenhuismortaliteit van 3,3% naar 2,4% is afgenomen (tabel 4a). Er lijkt dus sprake van een verschuiving van in-ziekenhuissterfte naar 30-dagensterfte waarbij er meer patiënten overlijden na ontslag. Een verklaring voor deze waarneming is niet uit de huidige DUCA-registratie te halen. Mogelijk dat late complicaties een rol spelen. In de groep patiënten met een maagcarcinoom was ook al in 2011 een hogere 30-dagenmortaliteit dan in-ziekenhuismortaliteit te zien, en nog steeds in 2012.
Het valt op dat de sterfte na een operatie vanwege een maagcarcinoom veel hoger is bij patiënten die een palliatieve resectie ondergaan of een operatie ondergaan waarbij geen resectie wordt verricht, dan bij patiënten die een in-opzet-curatieve resectie ondergaan (tabel 4b). Een snel progressieve ziekte zou dit verschil kunnen verklaren.
Vanwege de nog altijd kleine aantallen patiënten die postoperatief overleden (respectievelijk 58 en 60 patiënten, oftewel gemiddeld 1 tot 2 patiënten per ziekenhuis) is het in de DUCA nog niet zinvol om ziekenhuisvergelijkingen op postoperatieve mortaliteit weer te geven. Hierbij moet ook worden opgemerkt dat een adequate casemixcorrectie met dit lage aantal ‘events’ niet mogelijk is. Hierover is meer te lezen in hoofdstuk 3 “Casemix”.
Radicaliteit en lymfeklieropbrengst
Het percentage R0-resecties is in beide DUCA-registratiejaren nagenoeg stabiel (met een kleine verbetering in de groep patiënten die geopereerd worden vanwege een primair maagcarcinoom). De lymfeklieropbrengst is in dit korte tijdsbestek duidelijk toegenomen. De uitkomstparameters betreffende de pathologie komen uitgebreid aan de orde in het hoofdstuk 5 “Pathologie”.
MijnDUCA kwaliteitsparameters
Wekelijks worden via “MijnDUCA” de eigen DUCA-kwaliteitsparameters, afgezet tegen de landelijke gemiddelden, online teruggekoppeld aan het registrerende ziekenhuis. Op deze manier kunnen eventuele knelpunten in de zorgketen worden geïdentificeerd. Zo kunnen gericht lokale, regionale of zelfs landelijke verbetertrajecten ingericht worden.
Referenties
1.Casemix
Summary Samenvatting
- Een correctiemodel voor postoperatieve mortaliteit is op dit moment nog niet te maken vanwege het lage aantal overleden patiënten in de DUCA. Om deze reden is gekozen voor de uitkomst ‘gecompliceerd postoperatief beloop’.
- Bij patiënten met een slokdarmcarcinoom die geregistreerd zijn in de DUCA 2011-2012 is een gecompliceerd postoperatief beloop geassocieerd met pulmonale co-morbiditeit, diabetes mellitus, een ASA score van III of hoger, en het gebruik van immunosuppressiva. Voor patiënten met een maagcarcinoom is in de DUCA alleen een hogere leeftijd significant van invloed op deze uitkomstmaat in multivariate analyse.
- Ziekenhuizen verschillen in casemix. Het percentage patiënten met een gecompliceerd beloop vóór en na casemixcorrectie verschilt echter voor de meeste ziekenhuizen niet veel. Voor enkele ziekenhuizen lijkt dit verschil wel aanzienlijk en daarom relevant.
- Het correctiemodel heeft nog zijn beperkingen. Op termijn kan met meer patiënten in de DUCA dataset met grotere betrouwbaarheid voor casemix worden gecorrigeerd, en is ook voor postoperatieve mortaliteit een casemixmodel te maken. De huidige casemix-gecorrigeerde ziekenhuisvergelijkingen kunnen al wel waardevolle spiegelinformatie geven voor individuele ziekenhuizen en zo ingezet worden voor een interne kwaliteitsverbetering.
- Meer inzicht in de risico voorspellende waarde van de vele (patiënt)karakteristieken in de DUCA dataset biedt in de toekomst wellicht de mogelijkheid om de set casemixfactoren te verkleinen.
Voor het goed interpreteren van uitkomsten van zorg is het van belang patiënt- en tumorgebonden factoren te identificeren die van invloed zijn op de uitkomst. Dit worden “casemixfactoren” genoemd. In de DUCA worden alleen geopereerde patiënten geregistreerd. Vooralsnog is het datamodel er dus op afgestemd om factoren te registreren die van invloed zijn op het postoperatief beloop. Dit kunnen andere factoren zijn dan factoren die geassocieerd zijn met een ongunstige uitkomst na niet-chirurgische behandeling met bijvoorbeeld chemotherapie of radiotherapie.
Uit de wetenschappelijke literatuur zijn verschillende patiënt- en tumorgebonden factoren bekend die invloed hebben op de kans op complicaties en overlijden na een operatie1. Het ligt voor de hand dat een oudere patiënt met meer comorbiditeit en dus een kleinere reserve in orgaanfunctie, een groter risico heeft op complicaties na een operatie dan een jongere patiënt met minder comorbiditeit. Om uitkomstcijfers van ziekenhuizen te kunnen vergelijken met een landelijk gemiddelde of zelfs met elkaar, is in de DUCA voor alle patiënten een breed scala aan casemixfactoren betrokken in de registratie.
Casemixfactoren
Bij casemixfactoren, die van invloed zijn op het postoperatieve beloop van patiënten die een slokdarm-of maagresectie ondergaan, moet enerzijds worden gedacht aan patiëntkenmerken zoals leeftijd, comorbiditeit en gewichtsverlies voorafgaand aan de operatie en anderzijds aan tumorkarakteristieken, zoals het stadium van de ziekte. Welke casemixfactoren relevant zijn, hangt af van de gekozen uitkomst waarop ziekenhuizen vergeleken worden. Ook zijn casemixfactoren die van invloed zijn op korte termijnuitkomsten, zoals complicaties of 30-dagenmortaliteit, vaak andere factoren dan die van invloed zijn op de lange-termijnoverleving.
Het is tot op heden nog onduidelijk wat het beste correctiemodel is in de DUCA. Dit zal duidelijker worden na meerdere registratiejaren. Na twee jaar registreren in de DUCA komt postoperatieve mortaliteit nog altijd weinig voor in de database: er zijn in 2012 in de 25 deelnemende ziekenhuizen ongeveer 30 sterfgevallen geregistreerd bij patiënten geopereerd aan een slokdarmcarcinoom. Het vergelijken van ziekenhuizen op deze uitkomst is vooralsnog zinloos, omdat verschillen grotendeels op ‘toeval’ zullen berusten. Bij het maagcarcinoom zijn er in de DUCA in 2012 zelfs minder sterfgevallen geregistreerd dan dat er participerende ziekenhuizen zijn. Ook wanneer gegevens van twee jaar worden gecombineerd zijn dit erg weinig sterfgevallen. Bovendien kan hiervoor nog geen valide model voor casemixcorrectie gemaakt worden. Als uitkomstmaat is net als vorig jaar daarom gekozen voor een samengestelde maat: het "postoperatief gecompliceerd beloop". De definitie van deze gecombineerde uitkomstmaat, die ook in andere DICA-registraties wordt gebruikt, is te lezen in hoofdstuk 2 “Resultaten”.
Deze uitkomstmaat werd ook in het vorige jaarrapport gebruikt. Met alleen de gegevens van 2011 was het vorig jaar nog niet mogelijk om aparte correctiemodellen voor slokdarm- en maagcarcinoom te maken vanwege de kleine patiëntenaantallen. Dit jaar is er gebruik gemaakt van gepoolde gegevens van alle patiënten in DUCA die werden geopereerd voor een slokdarm- of maagcarcinoom in 2011 en 2012, zodat dit wel apart kon worden geanalyseerd. Tabel 1 geeft de prevalentie weer van de belangrijkste casemixfactoren voor de eerste twee registratiejaren van de DUCA.
| n=1304 | n=796 | ||
| Casemix factor | Slokdarmcarcinoom | Maagcarcinoom | |
| n=1304 | n=796 | ||
| Leeftijd | >70 <=80 jaar | 24% | 31% |
| >80 jaar | 2% | 17% | |
| Geslacht | man | 77% | 34% |
| Body Mass Index (BMI) | <20 kg/m2 | 7,8% | 11% |
| >30 kg/m2 | 17% | 11% | |
| Pulmonale comorbiditeit* | 17% | 16% | |
| Cardiale comorbiditeit** | 24% | 33% | |
| Perifeer stenoserend vaatlijden | 3,4% | 3,6% | |
| Diabetes | 16% | 16% | |
| Neurologische comorbiditeit*** | 13% | 15% | |
| Chronische nierinsufficientie | 1,0% | 3,6% | |
| Charlson comorbiditeitsindex | 1 | 26% | 23% |
| 2 of hoger | 24% | 31% | |
| ASA classificatie | II | 61% | 52% |
| III of hoger | 22% | 30% | |
| Bloedverdunners | 25% | 34% | |
| Immuunsuppressiva | 1,9% | 2,6% | |
| IV | 0,9% | 3,1% | |
| Tumorlocatie | proximaal-mid thorax | 13% | . |
| distaal thoracaal | 56% | . | |
| GOJ | 31% | . | |
| fundus | . | 10% | |
| corpus | . | 31% | |
| antrum-pylorus | . | 50% | |
| gehele maag | . | 5,0% |
In de DUCA hebben patiënten met een maagcarcinoom vaker bijkomende aandoeningen dan patiënten met slokdarmcarcinoom. Dit uit zich in een hogere Charlson comorbiditeitsindex en ASA-classificatie. Tevens is de gemiddelde leeftijd van patiënten met een maagcarcinoom hoger dan van patiënten met een slokdarmcarcinoom.
Het selecteren van de relevante factoren en vervolgens de uitkomst hiervoor corrigeren (casemixcorrectie) is een essentieel onderdeel van ‘clinical auditing’. Op die manier krijgen deelnemende clinici betekenisvolle informatie teruggekoppeld.
Invloed van casemixfactoren op uitkomsten
Tabel 2 geeft voor elke casemixfactor weer wat het percentage gecompliceerd postoperatief beloop was in de patiëntengroep die deze risicofactor had. In de hele groep patiënten met een slokdarmcarcinoom had 32% van de patiënten een gecompliceerd beloop. Echter, in de groep patiënten met een ASA-score van III of hoger was dit 47% en bij patiënten die immuunsuppressiva gebruikten was dit zelfs 62%. In de hele groep patiënten met een maagcarcinoom werd minder vaak een gecompliceerd beloop geregistreerd (21%). Dit was echter hoger in bijvoorbeeld de groep patiënten ouder dan 80 jaar (31%) en patiënten die een palliatieve resectie ondergingen (30%). De casemixfactoren met een significante relatie met de uitkomst in univariate analyse zijn opgenomen in het multivariate model. De uitkomsten hiervan, uitgedrukt in Odds Ratios en 95% betrouwbaarheidsintervallen, staan eveneens in tabel 2 rechts van de percentages. Vetgedrukte getallen geven aan dat in de multivariate analyse deze factor een significante associatie had met de uitkomst gecompliceerd beloop, onafhankelijk van de andere factoren. Uit de multivariate analyse blijkt dat er een verhoogd risico op een gecompliceerd postoperatief beloop bestaat voor patiënten met: een slokdarmcarcinoom pulmonale comorbiditeit, diabetes mellitus, een ASA-score van III of hoger en het gebruik van immuunsuppressiva. Vooral deze laatste factor verhoogt het operatierisico sterk: deze patiënten hebben ongeveer een drie maal zo hoge kans op een gecompliceerd beloop. Patiënten met een pathologisch vastgestelde stadium III-tumor hadden een iets verlaagd risico op een gecompliceerd beloop ten opzichte van patiënten met een tumor in stadium I of II. Mogelijk speelt patiëntselectie bij patiënten met een hoger tumorstadium een rol; bij een slechte conditie zal bij de patiënten met een hoger tumorstadium eerder worden gekozen voor definitieve chemoradiotherapie- en komen alleen de fittere patiënten in aanmerking voor resectie en dus voor registratie in de DUCA.
| Slokdarmcarcinoom | Maagcarcinoom | ||||||
| Gecompliceerd beloop | Gecompliceerd beloop | ||||||
| % | OR | 95% BI | % | OR | 95% BI | ||
| Postoperatief gecompliceerd beloop | 32% | 21% | |||||
| Casemixfactoren | |||||||
| Leeftijd# | > 70 jaar | 38%* | 1.34 | 0,96-1,87 | 24% | ||
| >80 jaar | . | 31%* | 1.84 | 1,19-2,83 | |||
| Geslacht | vrouw | 35% | 19% | ||||
| BMI | <20 kg/m2 | 43%* | 0.62 | 0,35-1,10 | 19% | ||
| >30 kg/m2 | 29%* | 0.98 | 0,66-1,45 | 15% | |||
| Comorbiditeit | pulmonaal | 40%* | 1.49 | 1,01-2,20 | 24%* | 1.11 | 0,70-1,77 |
| cardiaal | 38%* | 1.21 | 0,79-1,83 | 25%* | 0.91 | 0,58-1,43 | |
| perifeer vaatlijden | 43%* | 1.4 | 0,63-3,1 | 48% | |||
| diabetes mellitus | 38%* | 1.6 | 1,08-2,40 | 16% | |||
| neurologisch | 38%* | 1.35 | 0,86-2,10 | 29%* | 1.28 | 0,79-2,06 | |
| nierinsufficiëntie | 31% | 31% | |||||
| Charlson index | 2 of hoger | 37%* | 0.83 | 0,57-1,2 | 24% | ||
| ASA classificatie | III of hoger | 47%* | 1.72 | 1,17-2,51 | 28%* | 1.43 | 0,96-2,14 |
| Bloedverdunners | wel | 37%* | 0.9 | 0,59-1,39 | 27%* | 1.4 | 0,89-2,21 |
| Immuunsuppressiva | wel | 62%* | 3.2 | 1,16-9,17 | 25% | ||
| Eeerdere buik/thorax operatie | 35%* | 1.15 | 0,83-1,56 | 21% | |||
| Gewichtsverlies# | 3-5 kg | 34% | 23% | ||||
| 5-10 kg | 26% | 22% | |||||
| 10 of meer kg | 34% | 22% | |||||
| pTNM7 stadium | III | 29%* | 0.69 | 0,51-0,94 | 18% | ||
| IV | 14%* | 0.35 | 0,11-1,09 | 16% | |||
| Tumorlocatie | proximaal-mid thoracaal | 42% | 1 | referentie | . | ||
| distaal thoracaal | 32%* | 0.73 | 0,46-1,17 | . | |||
| GOJ | 25%* | 0.49 | 0,29-0,82 | . | |||
| fundus | . | 26% | |||||
| corpus | . | 23% | |||||
| antrum/pylorus | . | 19% | |||||
| gehele maag | . | 26% | |||||
Patiënten met een tumor op de slokdarm-maag-overgang hadden een lager risico op een ongewenste uitkomst dan patiënten met proximaal gelegen tumoren. In de groep patiënten met een maagcarcinoom was een leeftijd van boven de 80 jaar de enige factor die significant geassocieerd was met een verhoogde kans op een gecompliceerd beloop, onafhankelijk van de andere factoren. Overigens zijn de continue variabelen zoals leeftijd ter illustratie in categorieën weergegeven in tabel 2, maar zijn deze als niet-categorische variabelen in het correctiemodel opgenomen.
Het is waarschijnlijk dat bij voortgang van de DUCA-registratie andere risicofactoren kunnen worden geïdentificeerd, waardoor het correctiemodel de risico voorspellende waarde van het model zal verbeteren. Er kan ook overwogen worden om de weegfactoren vooraf vast te stellen en in te bouwen in het correctiemodel aan de hand van factoren uit de literatuur. De huidige analyses laten evenwel zien dat mogelijk met slechts een paar eenvoudig te meten factoren zoals de ASA-score en leeftijd een correctie voor casemix kan worden bereikt. Dat maakt de registratie van een aantal factoren in de toekomst wellicht overbodig.
Casemixcorrectie en ziekenhuisvariatie
Figuur 1 toont de spreiding tussen de individuele ziekenhuizen in het percentage patiënten met slokdarmcarcinoom met een ASA-score van III of meer. De figuur is illustratief voor de aanwezige variatie in factoren die van invloed kunnen zijn op het postoperatieve beloop. Verschillen in casemix tussen ziekenhuizen lijken dus relevant. Echter, ook is te zien dat de spreiding samenhangt met het aantal geregistreerde patiënten. De spreiding zal minder worden bij meer patiënten in de dataset, omdat de individuele ziekenhuisgegevens dan minder beïnvloed worden door uitschieters op basis van toeval. Figuur 2 toont de variatie tussen individuele ziekenhuizen in percentage maagcarcinoom patiënten van 80 jaar of ouder.
Ziekenhuisvergelijkingen
Het op een betrouwbare wijze vergelijken van uitkomsten tussen ziekenhuizen is nuttig, omdat het zorgprocessen kan identificeren die geassocieerd zijn met een hoge kans op een gewenste uitkomst (‘best practices’). Bovendien levert het spiegelinformatie op waarmee de behandelteams kunnen zien hoe zij presteren ten opzichte van de rest van het veld (‘benchmarking’). Figuur 3 toont de funnelplot voor ziekenhuisverschillen in ongecorrigeerd (dichte ruitjes) en gecorrigeerd (open ruitjes) percentage patiënten met slokdarmcarcinoom met een gecompliceerd postoperatief beloop.
Doordat het aantal patiënten in de dataset nog gering is, is de spreiding in deze uitkomst nog aanzienlijk. Evenwel is te zien dat er enkele ziekenhuizen zijn waarvan de percentages boven of onder de betrouwbaarheidsintervallen liggen. Hieraan kunnen waarschijnlijk nog geen conclusies verbonden worden: de volledigheid op landelijk niveau was met name in 2011 nog niet optimaal en het ontbreken van patiënten en ziekenhuizen kan invloed hebben op het gemiddelde en de betrouwbaarheidsintervallen. Als spiegelinformatie voor individuele ziekenhuizen kan dit echter al waardevolle informatie zijn.
Het tweede dat opvalt is dat het percentage gecompliceerd postoperatief beloop voor de meeste ziekenhuizen vóór en na casemixcorrectie niet veel verschilt. Voor enkele individuele ziekenhuizen is het verschil, met ongeveer 5 tot meer dan 10%, wel relevant. Hierbij moet worden opgemerkt dat voor patiënten met slokdarmcarcinoom, het huidige casemixmodel voor een groot deel gebaseerd is op de patiëntenpopulaties en uitkomsten in de twee ziekenhuizen met het grootste aantal patiënten in de DUCA.
Figuur 4 toont de ziekenhuisspreiding in het percentage postoperatief gecompliceerd beloop in de groep patiënten met een maagcarcinoom. De spreiding lijkt hier kleiner, ondanks het gegeven dat het aantal patiënten per ziekenhuis kleiner is dan bij het slokdarmcarcinoom.
Conclusie
Naarmate er meer patiënten in de DUCA geregistreerd worden, zullen uitspraken over verschillen tussen ziekenhuizen met meer zekerheid gedaan kunnen worden: het correctiemodel zal dan sterker zijn en de betrouwbaarheidsintervallen zullen kleiner zijn. Desalniettemin zijn funnelplots, zoals in figuur 3 en 4 gepresenteerd, nuttig voor de behandelteams in de ziekenhuizen, zodat ze weten waar zij staan ‘in het veld’ en op die manier worden gestimuleerd om zichzelf continu te verbeteren.
Referenties
1.Neo-adjuvante therapie
Summary Samenvatting
- In de landelijke richtlijnen worden preoperatieve chemoradiotherapie bij patiënten met een slokdarmcarcinoom en peri-operatieve chemotherapie bij patiënten met een maagcarcinoom geadviseerd.
- De lokalisatie van het carcinoom in het traject van proximale slokdarm naar distale maag bepaalt de keuze van de (voor)behandeling (chemoradiotherapie of perioperatieve chemotherapie).
- In DUCA 2011-2012 wordt 90 procent van de geopereerde patiënten met een slokdarmcarcinoom en 55 procent van de geopereerde patiënten met een maagcarcinoom voorbehandeld. Deze behandeling wordt afgemaakt door respectievelijk 98 procent en 77 procent van de patiënten. Met name bij het maagcarcinoom is er een grote spreiding tussen ziekenhuizen in het percentage patiënten dat wordt voorbehandeld.
- Het percentage patiënten met een maagcarcinoom dat ook postoperatieve chemotherapie ondergaat is laag (37%).
- Vanaf 80 jaar bij het slokdarmcarcinoom en vanaf 70 jaar bij het maagcarcinoom wordt steeds vaker afgezien van perioperatieve therapie. Co-morbiditeit speelt bij het maagcarcinoom waarschijnlijk een (grote) rol in deze beslissing.
In de oncologie worden patiënten vaak multidisciplinair behandeld. Hierbij worden verschillende typen behandelingen gecombineerd om te komen tot het beste overlevingsresultaat voor de patiënt. Ook bij de behandeling van een slokdarm- en maagcarcinoom wordt steeds vaker gebruik gemaakt van radiotherapie en chemotherapie rondom de chirurgische resectie. Radiotherapie en chemotherapie kunnen, eventueel gecombineerd, gegeven worden voorafgaand aan de operatie. Er is dan sprake van een neo-adjuvante behandeling. Als chemotherapie of radiotherapie aanvullend wordt gegeven na de operatie, is er sprake van een adjuvante behandeling.
Huidige richtlijn en ontwikkelingen
Slokdarmcarcinoom
De richtlijn slokdarmcarcinoom 20101 adviseert bij operabele patiënten met een resectabel slokdarmcarcinoom in een hoger stadium dan cT1N0, preoperatieve chemoradiotherapie gevolgd door radicale chirurgie. Preoperatieve chemoradiotherapie geeft een betere lokale controle, een hogere kans op een radicale resectie en een verbeterde overleving ten opzichte van alleen chirurgische resectie2.
In 2012 is de Nederlandse CROSS II studie gepubliceerd waaruit bleek dat preoperatieve chemoradiotherapie leidde tot een complete pathologische respons bij 29% van de patiënten (23% bij het adenocarcinoom en 49% bij het plaveiselcelcarcinoom) en een verhoogde kans op een radicale resectie3. Bovendien werd een significante verbetering van de mediane overleving van 49 versus 24 maanden geobserveerd. Op grond van deze data is het CROSS II chemoradiotherapie-schema op dit moment het meest gebruikte schema in Nederland.
Maagcarcinoom
De richtlijn maagcarcinoom uit 2009 adviseert bij operabele patiënten met een resectabel maagcarcinoom chirurgische resectie in combinatie met perioperatieve chemotherapie4, indien het klinisch stadium hoger is dan stadium I. Indien patiënten geen preoperatieve chemotherapie hebben ondergaan, kan bij een R1 resectie postoperatieve chemoradiotherapie worden overwogen.
De grootste gerandomiseerde studie naar perioperatieve chemotherapie is de MAGIC trial waarin patiënten gerandomiseerd werden tussen chirurgie met perioperatieve chemotherapie versus chirurgie alleen5. De algehele overleving was langer in de groep patiënten met perioperatieve chemotherapie. Echter, slechts bij 42% van de patiënten waren de geplande kuren volledig afgerond. Bij een meerderheid van de patiënten moest een dosisreductie plaatsvinden of de kuren gestaakt worden vanwege de bijwerkingen. In een latere trial werd aangetoond dat een alternatief schema een vergelijkbare werkzaamheid had met minder toxiciteit bij patiënten met een gemetastaseerd maagcarcinoom6.
In een Amerikaanse studie werden gunstige resultaten gerapporteerd van postoperatieve chemoradiotherapie7. Ook in deze studie bleek een groot gedeelte van de patiënten het schema niet te kunnen volbrengen vanwege de toxiciteit. Bovendien werd slechts bij 10% adequate chirurgie toegepast.
In het DUCA-invulformulier wordt in het tabblad ‘Diagnostisch proces’ geregistreerd waar de bulk van de tumor gelokaliseerd is: in de slokdarm (inclusief slokdarm-maagovergang) of in de maag. Uit de registratie blijkt dat preoperatieve behandeling veel vaker wordt toegepast bij patiënten met een slokdarmcarcinoom dan bij patiënten met een maagcarcinoom (tabel 1). Een percentage van 100% zal overigens nooit gehaald worden, omdat bij kleinere tumoren geen preoperatieve behandeling geadviseerd wordt (naast andere argumenten om geen voorbehandeling te starten). Opvallend is de praktijkvariatie in de toepassing van preoperatieve behandeling, die vooral groot is bij het maagcarcinoom, maar ook bij het slokdarmcarcinoom varieert tussen 60% en 100% (figuur 1).
| slokdarmcarcinoom | maagcarcinoom | |
| n=1294 | n=723 | |
| geen preoperatieve therapie | 129 (10%) | 319 (45%) |
| wel preoperatieve therapie | 1160 (90%) | 400 (55%) |
| onbekend | 5 (0%) | 4 (0%) |
Het is waarschijnlijk dat verschillen in casemix een deel van de praktijkvariatie verklaren. Vermoedelijk speelt vooral bij het maagcarcinoom de klinische inschatting van de tolerantie voor preoperatieve behandeling op basis van de comorbiditeit van de patiënt een rol. Over het algemeen zijn patiënten met een maagcarcinoom ouder, in een slechtere klinische conditie en hebben ze vaker ondergewicht dan patiënten met een slokdarmcarcinoom (zie hoofdstuk 2 “Resultaten en Kwaliteitsparameters”).
Het preoperatieve chemoradiotherapieschema bij patiënten met een slokdarmcarcinoom wordt vrijwel altijd afgemaakt (tabel 2). Preoperatieve chemotherapie wordt minder vaak volledig gegeven, zeker bij patiënten met een maagcarcinoom. Deze observaties suggereren dat het chemotherapieschema over het algemeen met meer toxiciteit gepaard gaat dan de chemoradiotherapie. Ook suggereren deze observaties dat dit bij patiënten met een maagcarcinoom bovendien minder tolerabel is dan bij patiënten met een slokdarmcarcinoom. Hierbij moet worden opgemerkt dat het preoperatieve chemoradiotherapieschema circa vijf weken duurt, terwijl het preoperatieve chemotherapieschema negen weken in beslag neemt.
| slokdarmcarcinoom | maagcarcinoom | ||
| chemoradiotherapie n=963 | chemotherapie n=188 | chemotherapie n=373 | |
| wel afgemaakt | 943 (98%) | 161 (86%) | 287 (77%) |
| niet afgemaakt | 19 (2,0%) | 27 (14%) | 77 (21%) |
| onbekend | 1 (0%) | . | 9 (2%) |
Na de chirurgische behandeling wordt bij een zeer klein gedeelte van de patiënten met een slokdarmcarcinoom aanvullende therapie toegepast, tegenover 37% bij de patiënten met een maagcarcinoom (tabel 3). Dit is conform de richtlijn waarin wordt geadviseerd dat patiënten met een slokdarmcarcinoom in principe alleen worden behandeld met preoperatieve chemoradiotherapie en patiënten met een maagcarcinoom met zowel pre- als postoperatieve chemotherapie. Opvallend is wel dat het percentage patiënten met een maagcarcinoom bij wie aanvullende behandeling wordt gestart in de Nederlandse praktijk zelfs nog lager is dan in de MAGIC trial werd beschreven (55%).
| slokdarmcarcinoom | maagcarcinoom | |
| n=1236 | n=653 | |
| geen postoperatieve therapie | 1103 (89%) | 397 (61%) |
| wel postoperatieve therapie | 68 (5,5%) | 243 (37%) |
| onbekend | 65 (5,5%) | 13 (2,0%) |
Figuur 2 geeft een overzicht van de gekozen perioperatieve behandeling naar sublokalisatie van de tumor in de slokdarm of maag. Patiënten met een slokdarmcarcinoom worden meestal met preoperatieve chemoradiotherapie behandeld. Bij patiënten met een tumor op de slokdarm-maagovergang wordt, naast het chemoradiotherapieschema, ook wel perioperatieve chemotherapie of alleen preoperatieve chemotherapie gegeven. Opvallend in de groep patiënten met een maagcarcinoom is dat hoe distaler de tumor in de maag is gelokaliseerd, hoe vaker wordt afgezien van perioperatieve behandeling. Daarnaast illustreert figuur 2 het percentage patiënten met een maagcarcinoom dat niet wordt nabehandeld.
Invloed van leeftijd en comorbiditeit op de keuze van de perioperatieve behandeling
Voor wat betreft de invloed van leeftijd op de keuze van de perioperatieve behandeling worden duidelijke verschillen gezien tussen de groep patiënten met een slokdarmcarcinoom en de groep patiënten met een maagcarcinoom (figuur 3). Bij het slokdarmcarcinoom worden de patiënten tot 80 jaar op eenzelfde wijze behandeld. Pas in de groep patiënten ouder dan 80 jaar wordt bij bijna de helft van de patiënten geen preoperatieve behandeling gegeven. Overigens betreft deze laatste groep een minderheid van de gehele groep patiënten met een slokdarmcarcinoom. Bij het maagcarcinoom is het beeld anders: al in de leeftijdscategorie tussen 70 en 80 jaar wordt bij ongeveer de helft van de patiënten afgezien van perioperatieve therapie, tot bijna 90% in de groep patiënten ouder dan 80 jaar.
Ingedeeld naar Charlson comorbiditeitsscore is er ook een verschil te zien tussen de groep patiënten met een slokdarmcarcinoom en de groep patiënten met een maagcarcinoom (figuur 4). Bij het slokdarmcarcinoom wordt preoperatieve behandeling niet toegepast bij 5% van de Charlson 0 patiënten tot 14% van de Charlson 2+ patiënten. Bij het maagcarcinoom is deze stijging – onder invloed van de Charlsonscore – nog duidelijker en wordt bij Charlson 2+ patiënten aan meer dan de helft van de patiënten geen perioperatieve therapie gegeven. Deze patronen zijn waarschijnlijk het gevolg van de verwachte toxiciteit van een perioperatieve behandeling bij een hogere leeftijd en meer comorbiditeit. Alleen een meer multidisciplinaire audit kan verder inzicht geven in onderliggende argumenten om een patiënt wel of niet voor of na te behandelen.
Referenties
1. 2.Pathologie
Summary Samenvatting
- Een volledige registratie van pathologische parameters is essentieel voor een uitkomstregistratie als de DUCA. Veel pathologische variabelen worden goed geregistreerd, maar het percentage patiënten bij wie alle pathologische gegevens bekend zijn in de DUCA is laag (19% van de patiënten met een slokdarmcarcinoom en 24% van de patiënten met een maagcarcinoom).
- Met name de afstanden van de tumor tot de proximale en distale snijranden en, in het geval van het slokdarmcarcinoom, de circumferentiële resectiemarge (CRM) ontbreken vaak, namelijk bij meer dan 40 procent van de patiënten. Wanneer alleen wordt gekeken naar patiënten bij wie dit is ingevuld, zijn de proximale en distale resectievlakken niet vaak tumorpositief (ca. 1 procent van de slokdarmcarcinoom patiënten en ca. 5 procent van de maagcarcinoom patiënten). De CRM is positief bij 11 procent van de patiënten met een slokdarmcarcinoom bij wie de CRM is ingevuld. Andere items die vaak ontbreken zijn het histologisch subtype bij adenocarcinomen en de differentiatiegraad van de tumor. De registratie van de pathologische respons op voorbehandeling is bij het slokdarmcarcinoom goed, maar bij het maagcarcinoom matig (bij 34% van de patiënten onbekend).
- De lymfeklieropbrengst zoals ingevuld in de eerste twee DUCA jaren is hoog, zowel bij patiënten met een primair slokdarmcarcinoom (mediaan 17 klieren) als bij patiënten met een primair maagcarcinoom (mediaan 18 klieren). Er wordt wel een aanzienlijke spreiding tussen de deelnemende ziekenhuizen gezien. Verschillen in de verdeling van transthoracale versus transhiatale slokdarmresecties en van totale versus partiële maagresecties zijn mogelijk van invloed.
- Een actieve participatie van pathologen in de registratie, in combinatie met een gestandaardiseerde verslaglegging in PALGA (slokdarm-maag module) kunnen bijdragen aan een kwaliteitsslag op het gebied van het pathologisch onderzoek van het (gereseceerde) slokdarm- en maagcarcinoom.
Voor een betrouwbare beoordeling en vergelijking van uitkomsten is volledigheid van de verslaglegging essentieel. In het pathologieverslag dient een minimale set van parameters vermeld te worden, die waarschijnlijk van invloed zijn op de prognose van de patiënt. Dat geldt uiteraard ook voor de pathologische verslaglegging in de DUCA.
Compleetheid van het pathologieverslag
Van alle in de DUCA geregistreerde patiënten die een in opzet curatieve resectie ondergingen in 2011 en 2012 was het verslag compleet (alle PA-items bekend) bij 19% van de patiënten met slokdarmcarcinoom en 24% van de patiënten met maagcarcinoom. In veel gevallen werd de onvolledigheid veroorzaakt door het ontbreken van informatie over de afstand tot de proximale en distale snijvlakken, en bij adenocarcinomen het histologisch subtype (zie tabel 1). Indien deze drie items buiten beschouwing worden gelaten zijn alle PA-items bij 64% en 61% van de patiënten bekend.
| Percentage onbekende gegevens | ||
| Item | Slokdarmcarcinoom | Maagcarcinoom |
| Histologie resectiepreparaat | 2,6% | 1,2% |
| Subtype adenocarcinoom* | 60% | 30% |
| Locatie tumor | 0,5% | 1,2% |
| Differentiatiegraad | 20% | 17% |
| pT stadium | 6,9% | 4,6% |
| pN stadium | 6,2% | 3,3% |
| Aantal lymfeklieren | 1,1% | 1,7% |
| Tumorpositieve klieren | 1,1% | 2,0% |
| Radicaliteit van de resectie | 1,3% | 3,2% |
| CRM | 45% | . |
| Proximale snijrand | 39% | 42% |
| Distale snijrand | 44% | 40% |
| Pathologische respons** | 7,5% | 34% |
Tabel 1 laat ook zien dat er een verschil is tussen het slokdarm- en maagcarcinoom wat betreft de registratie van de pathologische respons. Mogelijk dat verschillen in het percentage patiënten dat een voorbehandeling ondergaat en het type (chemotherapie of chemoradiotherapie) voorbehandeling hierbij een rol spelen.
Hoewel de wetenschappelijke commissie nastreeft om van de DUCA uiteindelijk een multidisciplinaire registratie te maken, worden de gegevens vrijwel in alle ziekenhuizen door chirurgen of nurse practitioners ingevoerd. Invoer van de pathologiegegevens door de patholoog gebeurt slechts incidenteel. Indien pathologen zelf de data invoeren, geeft dit directe terugkoppeling over de eigen verslaglegging. Dit zou de compleetheid van de verslagen kunnen verbeteren. Daarnaast wordt er gewerkt aan een protocollaire verslagleggingsmodule zoals reeds gebruikt wordt voor colon- en rectumtumoren. Implementatie van deze module maakt het autoriseren van incomplete verslagen onmogelijk1.
Snijranden
De radicaliteit van de resectie, uitgedrukt in tumorvrije snijranden, is voor zowel het slokdarm- als het maagcarcinoom een belangrijke uitkomstparameter. Tabel 1 toont dat incompleetheid van een verslag meestal veroorzaakt wordt door het ontbreken van informatie over de resectieranden. Voor het circumferentiële snijvlak worden verschillende definities voor radicaliteit gebruikt. De Engelse Royal College of Pathologists (RCP) beschouwt een tumorvrije marge < 1 mm als niet radicaal, terwijl de College of American Pathologists (CAP) een resectie alleen als niet radicaal beschouwt als de tumor in het snijvlak aanwezig is. Verschillende definities maken vergelijking onmogelijk en vermelding van de exacte marge blijft daarom belangrijk. Hoewel in de nieuwe (concept) richtlijn oesofaguscarcinoom wordt voorgesteld om de CAP-definitie aan te houden, is in de huidige DUCA-rapportage over 2012 nog de RCP-definitie aangehouden. Dit is tot op heden de definitie die DUCA hanteert en die ook in de helptekst bij het online registratieformulier staat. Verwarring over de te hanteren definitie en het over het hoofd zien van de helptekst kan hebben bijgedragen aan het hoge percentage ontbrekende gegevens.
Indien alleen gekeken wordt naar de patiënten bij wie de informatie over de resectieranden volledig is, blijkt dat de proximale en distale resectievlakken positief zijn in respectievelijk 1,1 en 1,4% bij het slokdarmcarcinoom en in respectievelijk 5,4 en 5,2% bij het maagcarcinoom (figuur 1).Ondanks de beperkingen van de gegevens, is er daarom wel een opvallend verschil tussen het slokdarm- en maagcarcinoom dat aandacht behoeft. Nadere analyse laat zien dat met name bij het diffuse type adenocarcinoom de verticale snijvlakken irradicaal zijn: bij 6,8% van de diffuse type adenocarcinomen in de slokdarm waren de proximale- en distale snijranden tumorpositief; bij de diffuse type adenocarcinomen in de maag was de proximale resectiemarge positief bij 5,1%, en de distale marge positief bij 6,3% van de patiënten. Het diffuse type adenocarcinoom komt in DUCA overigens frequenter voor in de maag (n=175; 32% van de patiënten met een bekend subtype) dan in de slokdarm (n=44; 5,5% van de patiënten met een bekend subtype). Bij plaveiselcelcarcinomen in de slokdarm werden geen irradicale verticale marges geregistreerd.
De circumferentiële resectiemarge (CRM) bij patiënten met een slokdarmcarcinoom is, wanneer wordt gekeken naar alle patiënten bij wie dit bekend is, positief bij 11% van de resecties.
Lymfeklieropbrengst
Het aantal verwijderde en onderzochte lymfeklieren weerspiegelt de kwaliteit van de chirurgische resectie en het pathologisch onderzoek. In het algemeen geldt dat hoe meer lymfeklieren onderzocht worden, hoe beter de prognostische waarde is. In de richtlijn maagcarcinoom is geen minimum aantal te onderzoeken lymfeklieren gedefinieerd, maar wordt geadviseerd zoveel mogelijk lymfeklieren te onderzoeken. In de richtlijn slokdarmcarcinoom wordt hierover geen uitspraak gedaan. De 7eeditie van de TNM-classificaties geeft aan dat een regionale lymfadenectomie normaal gesproken tenminste 6 (slokdarm) en 16 (maag) lymfklieren bevat. De huidige rapportage toont het percentage patiënten met 10 of meer lymfeklieren en 15 of meer lymfeklieren, omdat 10 gebruikt werd als ZZZ-indicator en 15 internationaal gehanteerd werd voor een goede lymfeklierdissectie bij het maagcarcinoom.
Het mediane aantal lymfeklieren geregistreerd in DUCA 2011-2012 was 17 (spreiding 0-69) en 18 (spreiding 0-72) voor respectievelijk het primair slokdarm- en maagcarcinoom. Voor het primair slokdarmcarcinoom werden in 82% van de resecties tenminste 10 en in 58% tenminste 15 lymfeklieren onderzocht. Voor het primair maagcarcinoom was dat respectievelijk 79 en 58%. Indien gekeken wordt naar spreiding tussen ziekenhuizen valt voor zowel het slokdarm- als maagcarcinoom op dat deze groot is (figuur 2).Dit zou deels verklaard kunnen worden door de verschillen in lymfeklieropbrengst voor de verschillende resecties (tabel 2): transthoracale slokdarmresecties hebben een hogere mediane lymfeklieropbrengst dan transhiatale resecties. Voor maagresecties geldt ook dat een totale maagresectie gepaard gaat met hogere aantallen onderzochte lymfeklieren dan partiële maagresecties.
| aantal lymfeklieren | THOCR | TTOCR | totale maagresectie | partiële maagresectie |
| gemiddeld | 14 | 20 | 20 | 17 |
| mediaan | 13 | 19 | 18 | 15 |
| spreiding | 0-43 | 0-54 | 2-71 | 0-72 |
| 10 of meer | 71% | 92% | 88% | 74% |
| 15 of meer | 39% | 73% | 65% | 55% |

Samenvatting NBCA
De kwaliteit van de zorg voor patiënten met een mammacarcinoom staat van oudsher in het centrum van de maatschappelijke belangstelling.
Registratie en volledigheid
Het Nationaal Borstkankeroverleg Nederland (NABON) heeft in 2009 het initiatief genomen tot het ontwikkelen van een multidisciplinaire set van kwaliteitsindicatoren voor de gehele zorgketen1. Er is vanaf het begin af aan een multidisciplinaire borstkankeraudit nagestreefd. De landelijke registratie, NABON Breast Cancer Audit (NBCA), wordt gefaciliteerd door IKNL (Integraal Kankercentrum Nederland) en DICA (Dutch Institute for Clinical Auditing). Ze is in 2011 van start gegaan. Ziekenhuizen kunnen deelnemen door zelf te registreren ofwel toestemming te geven voor overheveling van de gegevens via de Nederlandse Kankerregistratie (NKR). Gegevens in de NKR worden verzameld door IKNL of IKZ (Integraal Kankercentrum Zuid). Er vindt wekelijkse terugkoppeling aan de ziekenhuizen plaats op mijnNBCA waardoor ziekenhuizen gedurende het jaar gerichte verbeteringen kunnen aanbrengen.
Het afgelopen jaar is het aantal deelnemende ziekenhuizen aan de NBCA gestegen naar 98%. In 2012 hebben 39 ziekenhuizen gekozen zelf gegevens te registreren in de NBCA en 50 ziekenhuizen kozen voor overheveling van de gegevens via de Nederlandse Kankerregistratie.
Validatie van zelfgeregistreerde gegevens met de NKR-gegevens over 2011 op ziekenhuisniveau laat enige discrepantie in het aantal geregistreerde patiënten per indicator zien. De verklaring hiervoor kan zijn dat 2011 het eerste registratiejaar was van zelfregistrerende ziekenhuizen, waardoor ziekenhuizen ofwel later zijn gestart, ofwel de registratiesystematiek nog niet vloeiend verliep. De verschillen die gevonden worden, lijken de chirurgische indicatoren die extern worden uitgevraagd niet in positieve of negatieve zin te beïnvloeden. Wanneer het aantal patiënten in de NKR in 2011 als 100% wordt beschouwd, blijkt de landelijke dekking van de zelfregistrerende ziekenhuizen in de NBCA in 2011 al 90% te zijn. De verwachting is dat dit in 2012, het eerste echt complete registratiejaar, alleen maar is toegenomen.
Indicatoren
De indicatorenset bestaat zowel uit uitkomstindicatoren, die het resultaat van de behandeling meten, als procesindicatoren, die de kwaliteit van het zorgproces inzichtelijk maken. Ziekenhuizen scoren goed op de meeste indicatoren, zie tabel 1. Voor de indicatoren uitgevraagd door Zichtbare Zorg2 en de Inspectie voor de Gezondheidszorg 3 geldt dat de normen door de meeste ziekenhuizen ruim worden gehaald.
| % | Doorlooptijd range | Doorlooptijd mediaan | Doorlooptijd range | ||
| Patiënten | Deelname aan de NABON Breast Cancer Audit | ||||
| a1. Ziekenhuizen die deelnemen aan de NABON Breast Cancer Audit in 2011 | 88% | ||||
| a2. Ziekenhuizen die deelnemen aan de NABON Breast Cancer Audit in 2012 | 98% | ||||
| b. Percentage patiënten waarvan de informatie voor de externe indicatoren volledig is | 46% | 0-100% | |||
| Deelname aan klinisch wetenschappelijk onderzoek | |||||
| Percentage patiënten dat deelneemt aan wetenschappelijke studies | 8% | 0%-60% | |||
| Diagnostiek | Toepassing BI-RADS eindcategorie verslaglegging mammaradiologie | ||||
| Percentage patiënten met een BI-RADS eindcategorie | 98% | 87%-100% | |||
| Percentage patiënten pre-behandeling besproken in een multidisciplinair team | |||||
| a. Percentage patiënten dat besproken is* | 96% | 20%-100% | |||
| b. Beschikbaarheid van digitaal verslag voor alle behandelaars* | 92% | 1%-100% | |||
| c. Vermelding in het verslag dat alle benodigde specialismen vertegenwoordigd waren** | 44% | 0%-100% | |||
| Voorbehandeling | Neo-adjuvante therapie bij T4 tumoren | ||||
| Percentage patiënten dat neo-adjuvante therapie krijgt | 72% | 0%-100% | |||
| Consult radiotherapeut voor start neo-adjuvante therapie*** | |||||
| Percentage patiënten dat gezien wordt door de radiotherapeut | 23% | 0%-100% | |||
| Chirurgie | Irradicaliteit bij eerste mammasparende operatie voor invasief carcinoom* | ||||
| a. Meer dan focaal irradicale resectie | 5,6% | 0%-18% | |||
| b. Percentage patiënten waarbij de irradicaliteit onbekend is | 0,9% | 0%-9% | |||
| Irradicaliteit bij eerste mammasparende operatie voor DCIS* | |||||
| a. Focaal of meer dan focaal irradicaal resectie | 23% | 0%-100% | |||
| b. Percentage patiënten waarbij de irradicaliteit onbekend is | 2,8% | 0%-50% | |||
| Okselklierdissecties bij pN0 status | |||||
| a. Okselklierdissectie bij pN0(i-) | 4,1% | 0%-23% | |||
| b. Okselklierdissectie bij pN0(i+) | 2,3% | 0%-50% | |||
| c. Meer dan 5 schildwachtklieren verwijderd bij pN0(i-) | 2,1% | 0%-17% | |||
| d. Meer dan 5 schildwachtklieren verwijderd bij pN0(i+) | 2,2% | 0%-25% | |||
| Percentage patiënten postoperatief besproken in een multidisciplinair team | |||||
| a. Percentage patiënten dat besproken is* | 97% | 32%-100% | |||
| b. Beschikbaarheid van digitaal verslag voor alle behandelaars* | 96% | 27%-100% | |||
| c. Vermelding in het verslag dat alle benodigde specialismen vertegenwoordigd waren** | 51% | 0%-100% | |||
| Pathologie | Gestandaardiseerde verslaglegging patholoog | ||||
| a. Gestandaardiseerde pathologie verslaglegging | 89% | 47%-100% | |||
| b. Protocollaire verslaglegging in de PALGA protocol module** | 54% | 0%-100% | |||
| Aandeel HER2 positieve bepalingen | |||||
| Percentage positieve bepalingen | 13% | 0%-33% | |||
| Aandeel oestrogeen receptor positieve bepalingen | |||||
| Percentage positieve bepalingen ( ≥ 10% van de tumorcellen) | 86% | 74%-100% | |||
| Aandeel progesteron receptor positieve bepalingen | |||||
| Percentage positieve bepalingen ( ≥ 10% van de tumorcellen) | 71% | 55%-97% | |||
| Aanvullende therapie | Adjuvante chemotherapie bij vroeg stadium mammacarcinoom*** | ||||
| Percentage patiënten dat adjuvante chemotherapie krijgt | 90% | 63%-100% | |||
| Radiotherapie bij lokaal uitgebreid invasief mammacarcinoom*** | |||||
| Percentage patiënten dat radiotherapie krijgt | 82% | 33%-100% | |||
| Radiotherapie bij DCIS na mammasparende behandeling*** | |||||
| Percentage patiënten dat radiotherapie krijgt | 88% | 44%-100% | |||
| Wachttijden | Wachttijd tussen diagnose en aanvang preoperatieve chemotherapie* | ||||
| Patiënten binnen 5 weken na diagnose gestart met neo-adjuvante chemotherapie | 68% | 0%-100% | 29 | (1-412) | |
| Wachttijd tussen diagnose en operatie* | |||||
| Patiënten binnen 5 weken na diagnose geopereerd | 84% | 28%-100% | 22 | (0-394) | |
| Wachttijd tussen laatste operatie en aanvang radiotherapie*** | |||||
| a. Patiënten binnen 5 weken na operatie gestart met radiotherapie | 45% | 11%-85% | 38 | (0-170) | |
| b. Patiënten binnen 6 weken na operatie gestart met radiotherapie | 72% | 25%-96% | 38 | (0-170) | |
| Wachttijd tussen laatste chemotherapie gift en aanvang radiotherapie*** | |||||
| Patiënten binnen 4 weken na chemotherapie gestart met radiotherapie | 49% | 0%-100% | 29 | (2-268) | |
| Wachttijd tussen initiële behandeling en aanvang adjuvante chemotherapie*** | |||||
| a. Patiënten binnen 4 weken na operatie gestart met adjuvante chemotherapie | 46% | 0%-100% | 33 | (0-144) | |
| b. Patiënten binnen 4 weken na radiotherapie gestart met adjuvante chemotherapie | 86% | 48%-100% | 20 | (0-132) | |
| Follow up | Lokaal recidief na mammasparende operatie of ablatieve ingreep** | ||||
| a. Lokaal recidief in ipsilaterale borst na mammasparende operatie (2003-2006) | 2,0% | 0%-5% | |||
| b. Lokaal recidief in ipsilaterale thoraxwand na ablatieve ingreep (2003-2006) | 3,2% | 0%-12% |
De uitkomst van de indicator ‘irradicaliteit bij eerste mammasparende operatie voor een invasief mammacarcinoom’ is ook dit jaar laag; gemiddeld 5,6%. Er is geen enkel ziekenhuis dat meer dan 20% irradicale resecties heeft (figuur 1). Het percentage radicale resecties in Nederland is daarmee erg goed. Er hoeft daarom zelden een heroperatie verricht te worden: (79% van 5,6% = 4,4%). Internationaal gezien ligt het aantal heroperaties hoger, tot wel 22% in de Verenigde Staten4.
Ook het multidisciplinair bespreken van patiënten pre- en postoperatief is verder verbeterd; 96% van de patiënten wordt preoperatief besproken. Dit heeft een belangrijk effect op de kwaliteit van zorg. In 2011 scoorde 12% van de ziekenhuizen significant onder de norm van 90% voor het preoperatieve overleg5, dit jaar is dat nog 1 ziekenhuis.
De resultaten van indicatoren die de wacht- en doorlooptijden betreffen, variëren aanzienlijk tussen ziekenhuizen. Zowel de tijd van diagnose tot operatie als ook de tijd van operatie tot chemo- of radiotherapie wisselt. Een hoog ziekenhuisvolume of complexere patiënten kunnen bijvoorbeeld van invloed zijn op de doorlooptijden. Additionele procedures zoals het verrichten van een Magnetic Resonance Imaging (MRI)-scan preoperatief als ook een operatie waarbij direct een reconstructieve ingreep wordt uitgevoerd, verlengt de wachttijd van diagnose tot operatie. De voordelen van het verhogen van de snelheid waarmee een traject wordt doorlopen, dienen wel in het licht te worden gezien van de indicatie voor additionele onderzoeken of behandelingen zoals een MRI-scan of directe reconstructie.
Resultaten
Naast de items die noodzakelijk zijn voor de indicatoren worden in de NBCA ook andere items geregistreerd. Sommige van deze resultaten kunnen in de toekomst gebruikt worden als meting van de kwaliteit van zorg en daarom als indicator.
Neo-adjuvante therapie
Neo-adjuvante therapie kan overwogen worden voor tumoren waarbij tumorverkleining gewenst is en bij een locoregionaal uitgebreid mammacarcinoom (cT4)6. Van de cT4-tumoren ondergaat 70% systemische therapie. Dit geeft bij 82% van de patiënten een tumorreductie naar pathologisch T3 of kleiner. Van de klinische T3-tumoren wordt 20% na neo-adjuvante therapiemammasparend geopereerd. Zonder neo-adjuvante therapie ligt dit percentage aanzienlijk lager: 3%. Bij neo-adjuvantetherapie is een MRI-scan geïndiceerd in het kader van analyse van tumorregressie na de behandeling6. Een MRI-scan wordt voorafgaand gemaakt bij 71% van de patiënten die starten met neo-adjuvantechemotherapie.
Operatie
Het succes van een mammasparende operatie is bij niet-palpabele tumoren afhankelijk van de radiologische tumorlokalisatie. Tumorlokalisatietechnieken worden toegepast bij 75% van de niet-palpabele tumoren die een mammasparende operatie ondergaan. De meest gebruikte tumorlokalisatietechniek is de draadgeleide lokalisatie. Andere technieken, zoals de intra-operatieve echo zullen in de toekomst hun waarde bewijzen. Er is geen verschil tussen radicaliteit bij palpabele dan wel niet-palpabele tumoren. De keuze van tumorlokalisatietechniek lijkt geen invloed op de radicaliteit te hebben. Indien een invasief mammacarcinoom meer dan focaal irradicaal is, of indien een DCIS focaal of meer dan focaal irradicaal is, ondergaat het merendeel een heroperatie zoals is geadviseerd in de richtlijn6.
Patiënten die een ablatieve ingreep ondergaan, dienen van tevoren geïnformeerd te worden over de mogelijkheden van mammareconstructie6. Een mammareconstructie leidt tot een hogere patiënttevredenheid en een verbeterd lichaamsbeeld. Directe mammareconstructies worden bij 14% van de invasieve mammacarcinomen en 38% van de DCIS-tumoren verricht na een ablatieve ingreep. Er zijn 25 ziekenhuizen die (nog) geen directe mammareconstructies uitvoeren.
Pathologie
Adjuvante therapie wordt grotendeels gebaseerd op de uitslag van de oestrogeen- en progesteronreceptor en de HER2-status. Van belang is daarom dat er geen grote verschillen tussen ziekenhuizen zijn, omdat dit kan wijzen op een onjuiste kleuring van deze receptoren door het pathologie-instituut. Voor de vier receptorcategorieën worden er geen opvallende verschillen gevonden, met uitzondering van één ziekenhuis (relatief minder vaak HER2-negatief, hormoonreceptor-positief). Deze gegevens worden aan dit ziekenhuis teruggekoppeld om te kijken wat hiervan de oorzaak is.
Adjuvante therapie
Een indicatie voor adjuvante chemotherapie is een tumorpositieve okselklier, maar ook een ongunstige tumor zonder okselkliermetastasen (N0)6. Bij deze categorieën wordt adjuvante chemotherapie bij 66% van de patiënten gegeven. Anthracyclinen in combinatie met taxanen is de meest gegeven soort chemotherapie (85%). Endocriene therapie wordt gestart bij 68% van de patiënten. Naast de indicaties in de richtlijn spelen vele andere factoren een rol bij de uiteindelijke keuze voor adjuvante therapie zoals de wens van patiënten zelf, verwachte bijwerkingen en aanwezige comorbiditeit.
De richtlijnnaleving bij het toedienen van radiotherapie is hoog; 98% van de mammasparend behandelde invasieve mammacarcinomen en 88% van de DCIS-tumoren krijgt radiotherapie. Er is een grote variatie tussen radiotherapie-instituten in het geven van een ‘boost’ na mammasparende operatie, variërend van 35% tot 95% (figuur 2). Een ‘boost’ is een extra dosis radiotherapie ter plaatse van het operatiegebied, welke wordt gegeven naast de dosis toegediend op het gehele borstklierweefsel. Op basis van studies lijkt het toedienen van een ‘boost’ zinvol, het kan echter ook met ongewenste lange termijn gevolgen gepaard gaan7, 8. Het geven van een ‘boost’ zal daarom de komende jaren nader geëvalueerd moeten worden.
Lokaal recidief
Optimale lokale controle is een belangrijke uitkomstmaat voor de kwaliteit van zorg van patiënten met een vroeg stadium
mammacarcinoom.
De indicator ‘percentage lokaal recidief in de ipsilaterale borst na mammasparende operatie’ en ‘percentage
lokaal recidief in de ipsilaterale borst na ablatieve ingreep’ zijn vastgelegd door de Nederlandse Kankerregistratie
(NKR) ten behoeve van de uitvraag van indicatoren door Zichtbare Zorg.
Gegevens over patiënten die tussen 2003 en 2006 zijn behandeld vanwege een vroeg stadium mammacarcinoom laten een lokaal
recidiefpercentage van gemiddeld 2,5% binnen 5 jaar zien.
Het aantal lokaal recidieven is de afgelopen jaren gedaald; van 2,5% in 2003 naar 1,5% in 2006 voor de mammasparende
operaties en van 3,5% naar 2,7% na ablatieve chirurgie. Er worden geen verschillen tussen de ziekenhuizen gevonden.
Lokale controle van het vroeg stadium mammacarcinoom is in Nederland uitzonderlijk goed en verbetert nog steeds. Er zijn
weinig internationale cijfers bekend over recidieven bij het mammacarcinoom. In Denemarken ligt het recidiefpercentage op
2,0% van de mammasparende operaties en 2,1% na ablatieve chirurgie9. Engeland heeft een lokaal recidiefpercentage
van 3,5% binnen 5 jaar na de mammasparende operatie10.
Referenties
1.Registratie en volledigheid
Summary Samenvatting
- Het Nationaal Borstkankeroverleg Nederland (NABON) heeft in 2009 het initiatief genomen tot het ontwikkelen van een multidisciplinaire set van kwaliteitsindicatoren voor de gehele zorgketen.
- De landelijke registratie wordt gefaciliteerd door IKNL (Integraal Kankercentrum Nederland) en DICA (Dutch Institute for Clinical Auditing).
- Het afgelopen jaar is het aantal deelnemende ziekenhuizen aan de NABON Breast Cancer Audit (NBCA) gestegen naar 98%. In 2012 hebben 39 ziekenhuizen gekozen zelf gegevens te registreren in de NBCA, 50 ziekenhuizen kozen voor overheveling van de gegevens via de Nederlandse Kankerregistratie (NKR). Gegevens in de NKR worden verzameld door IKNL of IKZ (Integraal Kankercentrum Zuid).
- Validatie van zelfgeregistreerde gegevens met de NKR-gegevens over 2011 op ziekenhuisniveau laat enige discrepantie in het aantal geregistreerde patiënten per indicator zien. De verklaring hiervoor kan zijn dat 2011 het eerste registratiejaar is van zelfregistrerende ziekenhuizen waardoor ziekenhuizen ofwel later zijn gestart, ofwel de registratiesystematiek nog niet vloeiend verliep. De verschillen die gevonden worden, lijken de chirurgische indicatoren die extern worden uitgevraagd niet in positieve of negatieve zin te beïnvloeden.
- Wanneer de NKR aantallen in 2011 als 100% worden beschouwd, blijkt de landelijke dekking van de zelfregistrerende ziekenhuizen in de NBCA in 2011 al 90% te zijn. De verwachting is dat dit de komende jaren toeneemt omdat 2011 het eerste jaar van registratie was.
Inleiding
In de Nederlandse kankerzorg staat de kwaliteit van de zorg voor patiënten met een mammacarcinoom van oudsher in het centrum van de maatschappelijke belangstelling. Hoewel in internationale vergelijkingen de overleving van patiënten met een mammacarcinoom in Nederland tot de hoogste in Europa behoort, zijn er aanwijzingen dat er tussen ziekenhuizen variatie bestaat in behandelkeuzes, zoals verschillen in de voorkeur voor een sparende of ablatieve ingreep1. In 2004 kwam de Inspectie voor de Gezondheidszorg (IGZ) met de eerste landelijke prestatie-indicatoren voor de behandeling van borstkanker2. Ook in het programma Zichtbare Zorg Ziekenhuizen behoorde borstkanker tot één van de eerste ziektebeelden waarvoor een set verplichte kwaliteitsindicatoren werd ontwikkeld3.
Nationaal Borstkanker Overleg Nederland
In 2009 werd op initiatief van het Nationaal Borstkanker Overleg Nederland (NABON) een werkgroep opgericht met gemandateerde leden van alle beroepsverenigingen die betrokken zijn bij de behandeling van borstkanker. Het betreft borstkankerchirurgen, radiologen, pathologen, radiotherapeuten, internist-oncologen en plastisch chirurgen. Bij de behandeling van patiënten met borstkanker zijn deze verschillende disciplines op verschillende momenten in het zorgproces betrokken. Ook de Borstkankervereniging (BVN) wordt in de werkgroep vertegenwoordigd.
De werkgroep heeft tot doel een multidisciplinaire set van kwaliteitsindicatoren voor de behandeling van borstkanker te ontwikkelen. Er zijn 24 indicatoren ontwikkeld, met een uitgebreide beschrijving van de patiëntengroep waarop de indicator van toepassing is. Tabel 1 beschrijft een overzicht van de indicatoren en op welk aspect van het zorgproces de indicator van toepassing is.
| Patiënten | Deelname aan de NABON Breast Cancer Audit |
| Deelname aan klinisch wetenschappelijk onderzoek | |
| Diagnostiek | Toepassen BI-RADS eindcategorieën in de radiologische verslaglegging |
| Percentage patiënten dat pre-behandeling is besproken in een multidisciplinair team | |
| Voorbehandeling | Neo-adjuvante therapie bij klinische T4 tumoren |
| Percentage patiënten met neo-adjuvante therapie dat pre-behandeling gezien wordt door de radiotherapeut | |
| Wachttijd tussen diagnose en aanvang neo-adjuvante chemotherapie | |
| Operatie | Wachttijd tussen diagnose en eerste operatie (inclusief directe reconstructie) |
| Irradicaliteit bij eerste mammasparende operatie voor invasief mammacarcinoom | |
| Irradicaliteit bij eerste mammasparende operatie voor DCIS | |
| Okselklierdissecties bij pathologisch N0 | |
| Percentage patiënten dat postoperatief is besproken in een multidisciplinair team | |
| Pathologie | Gestandaardiseerde verslaglegging patholoog |
| Aandeel HER2 positieve bepalingen | |
| Aandeel oestrogeen positieve bepalingen | |
| Aandeel progesteron positieve bepalingen | |
| Adjuvante therapie | Adjuvante chemotherapie bij vroeg stadium mammacarcinoom |
| Wachttijd tussen initiële behandeling en aanvang adjuvante chemotherapie | |
| Percentage patiënten dat radiotherapie krijgt bij lokaal uitgebreid mammacarcinoom waarvoor ablatieve ingreep | |
| Percentage patiënten dat radiotherapie krijgt bij DCIS na mammasparende behandeling | |
| Wachttijd tussen laatste chirurgische ingreep en start radiotherapie | |
| Wachttijd tussen eerste dag laatste chemotherapie kuur en start radiotherapie | |
| Follow up | Percentage patiënten met een lokaal recidief in de ipsilaterale borst na mammasparende operatie |
| Percentage patiënten met een lokaal recidief in de thoraxwand na ablatieve ingreep |
NABON Breast Cancer Audit (NBCA)
Van het begin af aan is door alle betrokken partijen een multidisciplinaire borstkankeraudit nagestreefd. De registratie wordt gefaciliteerd door medewerkers van de Nederlandse Kankerregistratie (NKR) en het Dutch Institute for Clinical Auditing (DICA).
Idealiter worden de voordelen van ‘clinical auditing‘, met de snelle online feedback-cyclus aan behandelteams in de ziekenhuizen (mijnNBCA), standaard gecombineerd met de registratie-ondersteuning en onafhankelijke validatie van ziekenhuisspecifieke gegevens door de NKR.
Ziekenhuizen hebben de keuze gekregen of ze zelf gegevens in het web-based systeem van DICA invoeren (door eigen datamanagers of gespecialiseerde verpleegkundigen), hierna “zelfregistreerders” genoemd, danwel toestemming geven tot overheveling van de gegevens vanuit de NKR. Gegevens worden in dat laatste geval door medewerkers van de NKR geregistreerd en per kwartaal voorgelegd aan de behandelaars in de ziekenhuizen voor inhoudelijke correctie. Aangezien de focus van de audit de afgelopen twee jaren met name op de chirurgische aspecten van de borstkankerzorg heeft gelegen, heeft een deel van de zelfregistrerende ziekenhuizen vooral de chirurgische items ingevuld. Derhalve zijn de gegevens betreffende de aanvullende therapie voor deze ziekenhuizen vaak incompleet. In de loop van 2013 zullen beide vormen van registratie worden geïntegreerd in één NBCA-registratiesysteem. De invoer is dan flexibel en kan zowel vanuit de ziekenhuizen als door de registratiemedewerkers van de NKR uitgevoerd worden, met in beide situaties kruislingse validatie van de ingevoerde gegevens.
Deelnemende ziekenhuizen
In Nederland zijn er 95 ziekenhuizen waar de diagnostiek en behandeling van borstkankerpatiënten wordt uitgevoerd. Hiervan verlenen 8 ziekenhuizen de borstkankerzorg gezamenlijk met een ander ziekenhuis; deze 8 ziekenhuizen worden daarom als 4 ziekenhuizen beschouwd. Deze rapportage betreft gegevens van 89 ziekenhuizen (98%). Dit is een grote vooruitgang vergeleken met het eerste registratiejaar, waarbij 88% van de ziekenhuizen deelnam. Van 2 ziekenhuizen waren er op 1 april 2013 (nog) geen gegevens beschikbaar voor de NBCA-jaarrapportage.
De gegevens van 39 ziekenhuizen zijn afkomstig van zelfregistreerders, van 50 ziekenhuizen zijn de gegevens afkomstig uit de NKR. We zien ten opzichte van 2011 een lichte toename van het percentage zelfregistrerende ziekenhuizen.
In figuur 1 is een overzicht van het aantal geregistreerde patiënten per ziekenhuis en per gegevensbron.
NBCA-jaar
De NBCA-registratieperiode gaat niet per kalenderjaar, zoals bij de andere DICA-registraties het geval is. Voor de uitvraag van de indicatoren door Zichtbare Zorg en IGZ moeten de gegevens over de eerste behandeling van patiënten beschikbaar zijn. Daarom is gekozen het jaar een kwartaal te verschuiven. In het jaarrapport wordt dit specifieke jaar het NBCA-jaar genoemd. Het NBCA-jaar 2012 beslaat de periode van 1 oktober 2011 tot en met 30 september 2012. De resultaten en de indicatoren worden over deze periode beschreven. Negen ziekenhuizen zijn per 2012 deelnemer geworden, zij hebben daarom slechts gegevens over de laatste drie kwartalen van het registratiejaar en missen de laatste drie maanden van 2011.
Het NBCA-jaar 2011 is door de start van de (toen nog) DBCA op 1 januari 2011 geen volledig registratiejaar en beslaat de eerste negen maanden van 2011.
De behandeling van patiënten met borstkanker bestaat vaak uit verschillende behandelmomenten, waarvan één of meerdere operaties, bestraling en systemische therapie deel uit kunnen maken. De volgorde hiervan kan wisselen. Dergelijke combinaties van behandelingen kunnen meer dan zes maanden in beslag nemen. De operatie vindt doorgaans vroeg in het proces plaats en gegevens daarover zijn daarom snel beschikbaar. Dit geldt niet voor de gegevens over radio-, chemo-, immuno- en/of hormoontherapie. Gegevens over aanvullende behandelingen worden daarom weergegeven voor het kalenderjaar 2011. Om een zo betrouwbaar mogelijk beeld te kunnen geven, zijn voor deze behandelingen alleen gegevens gebruikt die vanuit de NKR zijn verkregen.
Bepaalde gegevens kunnen ontbreken of onbekend zijn. Voor de externe indicatoren (hoofdstuk 2) worden patiënten van wie deze informatie ontbreekt wel meegenomen in de berekening van de teller van de indicator. De externe indicatoren worden namelijk aangeleverd aan Zichtbare Zorg en IGZ en dienen compleet te zijn. Omdat de interne indicatoren tot dusver vooral een procesweergave zijn, worden bij de analyses de missende waardes van deze indicatoren niet meegenomen om een zo waarheidsgetrouw mogelijk beeld te schetsen van de uitkomsten.
Aantal patiënten
In de totale database zijn 26.417 patiënten ingevoerd. Voor patiënten vanuit zelfregistrerende ziekenhuizen geldt dat alleen analyseerbare patiënten zijn gebruikt in de rapportage. Een patiënt is analyseerbaar indien er een operatie heeft plaatsgevonden en de datum van het biopt en de invasiviteit zijn ingevoerd (n=24.715). Patiënten met afstandsmetastasen ten tijde van de primaire presentatie (n=216) zijn geëxcludeerd. Reden hiervoor is dat gedurende de jaren wisselend gecommuniceerd is of deze patiënten al dan niet geïncludeerd moesten worden.
Dit resulteert in 14.158 patiënten in het NBCA-jaar 2012 en 11.830 in het kalenderjaar 2011. In het NBCA-jaar 2012 zijn 5.421 patiënten afkomstig van zelfregistrerende ziekenhuizen en 8.737 van de NKR. De resultaten van de zelfregistrerende ziekenhuizen worden gecombineerd gepresenteerd met de gegevens van de NKR.
Volledigheid
Het doel van de NBCA is inzage te geven aan de deelnemende ziekenhuizen over de kwaliteit van de verleende zorg. Deze interne stuurinformatie kan worden vergeleken met de gegevens van andere ziekenhuizen. Daarnaast worden externe kwaliteitsindicatoren aangeleverd aan derden. (Dit gebeurt in principe door de ziekenhuizen zelf.) Dit vereist dat de gegevens op eenduidige wijze verzameld zijn, en compleet en vergelijkbaar zijn. De volledigheid van de verschillende items is groot.
Bijna alle chirurgische items in het NBCA-jaar 2012 zijn door de zelfregistrerende ziekenhuizen voor meer dan 95% ingevuld. Gegevens van de NKR zijn voor vrijwel 100% volledig.
Validatie
Voor de zelfregistrerende ziekenhuizen, maar ook voor de registratie door de NKR is de kwaliteit/reproduceerbaarheid van de gegevens van essentieel belang.
- De NBCA streeft naar kruislingse dataverificatie:
- Als gegevens uit de NKR worden gebruikt (n=50 ziekenhuizen), dan worden de gegevens periodiek voorgelegd aan de behandelaars. Hen wordt gevraagd de gegevens te controleren en aan te vullen in geval van onjuistheden. De medewerkers van de NKR passen na controle de registratie aan op basis van deze terugkoppeling. De validatie vindt doorlopend plaats sinds januari 2011.
- Als gegevens die door de instelling zelf zijn ingevoerd in de NBCA worden gebruikt (n=39 ziekenhuizen), dan zullen de gegevens in de toekomst gevalideerd worden op basis van gegevens uit de NKR. In 2011 en 2012 is de kruislingse validatie voor zelfregistreerders nog niet standaard geëffectueerd. Als test werd kruislingse validatie uitgevoerd voor 26 ziekenhuizen.
Werkwijze
De gegevens van zelfregistrerende ziekenhuizen zijn vergeleken met informatie uit de NKR. Daarbij is gekeken naar het aantal geregistreerde patiënten en naar de externe indicatoren van 2011. Tabel 2 geeft een overzicht van de aantallen patiënten.
| Zelfregistratie in NBCA | NKR | |
| Aantal ziekenhuizen | 26 | 26 |
| Aantal records | 3549 | 3940 |
| Aantal bruikbare records | 3265 | 3940 |
Uitkomsten
Bij veertien ziekenhuizen (54%) is het verschil tussen het aantal patiënten dat zelf is vastgelegd en het aantal in de NKR minder dan tien patiënten (zie figuur 2). Negen ziekenhuizen (35%) hebben zelf veel minder patiënten vastgelegd vergeleken met de NKR, en één ziekenhuis heeft 17 patiënten meer vastgelegd. Een mogelijke reden voor minder geregistreerde patiënten kan zijn dat 2011 het eerste jaar was van vastlegging van deze gegevens door zelfregistrerende ziekenhuizen. Mogelijk is de registratie in deze ziekenhuizen op een later tijdstip gestart, lopende het registratiejaar, waardoor onvolledig is geregistreerd. Het kan ook zijn dat de registratiesystematiek in deze ziekenhuizen nog niet helemaal vloeiend verliep bij de start van de registratie.
Tevens zijn de uitkomsten op de indicatoren per ziekenhuis vergeleken. Figuur 3 toont per ziekenhuis de uitkomst op de indicator ‘het percentage patiënten dat binnen vijf weken na de eerste diagnostische verrichting is geopereerd’. Voor twee ziekenhuizen (7,7%) wijkt de uitkomst meer dan 10% af, waarbij de één lager scoort en de ander hoger. In figuur 3 is ook zichtbaar dat het verschil tussen de scores van zelfregistratie en registratie door de NKR groter lijkt bij instellingen die andere aantallen patiënten hebben in de registratie (de driehoekjes). Er wordt niet gezien dat zelfregistreerders structureel beter scoorden op basis van hun zelfgeregistreerde gegevens dan op basis van de gegevens in de NKR. Bij de vergelijkingen voor andere externe indicatoren, zoals ‘het percentage patiënten dat wordt besproken in pre- en postoperatief MDO’ en ‘het percentage patiënten met irradicale resecties voor zowel invasief mammacarcinoom als DCIS’, wordt eenzelfde beeld gezien (hier niet getoond). Alleen bij het pre- en het postoperatief MDO lijkt een deel van de ziekenhuizen beter te scoren bij zelfregistratie. Een mogelijke reden hiervoor kan zijn dat 2011 het eerste jaar was van vastlegging van deze gegevens in de NKR, waardoor deze gegevens voor de registratiemedewerkers mogelijk nog niet goed vindbaar waren in de medische administratie van ziekenhuizen.
De validatie van gegevens vindt plaats op het niveau van het behandelende ziekenhuis. Op het niveau van de individuele patiënt heeft er (nog) geen matching van de gegevens plaatsgevonden. Daardoor is het nu niet mogelijk om precies aan te geven bij welke patiënten er sprake is van discrepanties in de vergelijking tussen de twee registratiemethodes en wat de oorzaak daarvan kan zijn.
Bij het registreren van grote aantallen patiënten is het onvermijdelijk dat er (minimale) verschillen ontstaan in de vastlegging van de gegevens.Het is van belang dat deze verschillen ‘random’ zijn, en niet zijn gebaseerd op verschillen in (de interpretatie van) coderingen of het selectief vastleggen van bepaalde informatie. Inzage in verschillen door validatie van de gegevens draagt bij aan de verdere verbetering van de kwaliteit van de registratie. In 2013 zullen DICA en NKR in overleg met de ziekenhuizen de validatie van gegevens verder ontwikkelen om zo de kwaliteit van de gegevens verder te verhogen.
Referenties
1.Indicatoren
Summary Samenvatting
- Een werkgroep van het Nationaal Borstkankeroverleg Nederland (NABON) heeft een indicatorenset ontwikkeld met als doel de gehele keten van borstkankerzorg in kaart te brengen. Deze bestaat zowel uit uitkomstindicatoren als procesindicatoren. Een deel van deze indicatoren is momenteel extern (openbaar).
- Ziekenhuizen scoren goed op de meeste indicatoren. De indicatoren uitgevraagd door Zichtbare Zorg en de Inspectie voor de Gezondheidszorg worden door de meeste ziekenhuizen ruim gehaald.
- De uitkomst van de indicator ‘irradicaliteit bij eerste mammasparende operatie voor een invasief mammacarcinoom’ is ook dit jaar laag; 5,6%. Er is geen enkel ziekenhuis dat meer dan 20% irradicale resecties heeft.
- Ook het multidisciplinair bespreken van patiënten pre- en postoperatief is verder verbeterd. Dit heeft een belangrijk effect op de kwaliteit van zorg. In 2011 scoorde 12% van de ziekenhuizen significant lager dan de norm van 90% voor het preoperatieve overleg, dit jaar is dat nog 1 ziekenhuis.
- De resultaten voor indicatoren betreffende de wachttijden variëren aanzienlijk tussen ziekenhuizen. Zowel de tijd van diagnose tot operatie als de tijd van operatie tot chemo- of radiotherapie wisselt. Een hoog ziekenhuisvolume of complexere patiënten kunnen bijvoorbeeld van invloed zijn op de doorlooptijd. Additionele procedures zoals het verrichten van een Magnetic Resonance Imaging (MRI)-scan preoperatief als ook een operatie waarbij direct een reconstructieve ingreep wordt uitgevoerd, verlengen de wachttijden.
Inleiding
De betrokken disciplines bij de behandeling van borstkanker zijn radiologie (NVvR), chirurgie (NVCO-NVvH), radiotherapie (NVRO), medische oncologie (NVMO), pathologie (NVvP) en plastische chirurgie (NVPC). Deze beroepsgroepen hebben in een gezamenlijke werkgroep van het Nationaal Borstkankeroverleg Nederland (NABON) multidisciplinaire kwaliteitsindicatoren ontwikkeld, met als doel de kwaliteit van de gehele keten van zorg voor borstkankerpatiënten te omvatten.
De uitgevraagde indicatoren van Zichtbare Zorg1 en de indicatoren van de Inspectie voor de Gezondheidszorg (IGZ)2 zijn op de indicatorenset van de NABON Breast Cancer Audit (NBCA) afgestemd3. Hierdoor kunnen de gegevens die bij de ziekenhuizen worden uitgevraagd uit een betrouwbare bron worden aangeleverd. Zoals eerder beschreven in hoofdstuk 1‘Registratie en Volledigheid’ kunnen ziekenhuizen zowel zelf registreren als gebruik maken van aanlevering van patiëntgegevens via de Nederlandse Kankerregistratie (NKR). Ziekenhuizen hebben daarom de keuze om bij het uitvragen van de indicatoren door Zichtbare Zorg en IGZ gebruik te maken van eigen ingevoerde gegevens, of van aanlevering van gegevens die door de NKR-medewerkers zijn verzameld.
De uitgevraagde indicatoren van Zichtbare Zorg en IGZ vormen een beperkt gedeelte van de gehele NBCA indicatorenset, vooral gericht op de chirurgische items. Dit zijn de zogenoemde externeindicatoren. Deze resultaten worden wekelijks aan ziekenhuizen teruggekoppeld op mijnNBCA. Deelnemende ziekenhuizen kunnen daardoor gedurende het jaar hun prestatie op de indicatoren zien, vergelijken met anderen en eventuele veranderingen constateren. Een voordeel hiervan is dat er door het jaar heen gerichte proces- en kwaliteitsverbeteringen kunnen worden ingezet. Interne indicatoren zijn opgesteld met als doel om de inrichting en kwaliteit van het zorgproces inzichtelijk te maken; deze zijn vooralsnog niet beschikbaar op naam van het ziekenhuis, voor derden en ook (nog) niet direct opvraagbaar bij de deelnemende ziekenhuizen. De gegevens van deze interne indicatoren zijn wel in deze (geanonimiseerde) totaalanalyse opgenomen.
In dit hoofdstuk worden de resultaten van alle indicatoren besproken, zowel van de interne als externe indicatoren. De meeste indicatoren voor het mammacarcinoom zijn procesindicatoren. Dit zijn bijvoorbeeld indicatoren betreffende de doorlooptijden en wachttijden tussen verschillende behandelingen. Naast procesindicatoren zijn er ook uitkomstindicatoren. Een uitkomstindicator, zoals ‘irradicaliteit bij eerste mammasparende operatie voor invasief mammacarcinoom’, geeft inzicht in de uitkomst van een bepaalde behandeling. De gemiddelde uitkomsten van de indicatoren en de spreiding tussen de hoogst en laagst scorende ziekenhuizen worden weergegeven in tabel 1.
| % | Doorlooptijd range | doorlooptijd mediaan | Doorlooptijd range | ||
| Patiënten | Deelname aan de NABON Breast Cancer Audit | ||||
| a1. Ziekenhuizen die deelnemen aan de NABON Breast Cancer Audit in 2011 | 88% | ||||
| a2. Ziekenhuizen die deelnemen aan de NABON Breast Cancer Audit in 2012 | 98% | ||||
| b. Percentage patiënten waarvan de informatie voor de externe indicatoren volledig is | 46% | 0-100% | |||
| Deelname aan klinisch wetenschappelijk onderzoek | |||||
| Percentage patiënten dat deelneemt aan wetenschappelijke studies | 8% | 0%-60% | |||
| Diagnostiek | Toepassing BI-RADS eindcategorie verslaglegging mammaradiologie | ||||
| Percentage patiënten met een BI-RADS eindcategorie | 98% | 87%-100% | |||
| Percentage patiënten pre-behandeling besproken in een multidisciplinair team | |||||
| a. Percentage patiënten dat besproken is* | 96% | 20%-100% | |||
| b. Beschikbaarheid van digitaal verslag voor alle behandelaars* | 92% | 1%-100% | |||
| c. Vermelding in het verslag dat alle benodigde specialismen vertegenwoordigd waren** | 44% | 0%-100% | |||
| Voorbehandeling | Neo-adjuvante therapie bij T4 tumoren | ||||
| Percentage patiënten dat neo-adjuvante therapie krijgt | 72% | 0%-100% | |||
| Consult radiotherapeut voor start neo-adjuvante therapie*** | |||||
| Percentage patiënten dat gezien wordt door de radiotherapeut | 23% | 0%-100% | |||
| Chirurgie | Irradicaliteit bij eerste mammasparende operatie voor invasief carcinoom* | ||||
| a. Meer dan focaal irradicale resectie | 5,6% | 0%-18% | |||
| b. Percentage patiënten waarbij de irradicaliteit onbekend is | 0,9% | 0%-9% | |||
| Irradicaliteit bij eerste mammasparende operatie voor DCIS* | |||||
| a. Focaal of meer dan focaal irradicaal resectie | 23% | 0%-100% | |||
| b. Percentage patiënten waarbij de irradicaliteit onbekend is | 2,8% | 0%-50% | |||
| Okselklierdissecties bij pN0 status | |||||
| a. Okselklierdissectie bij pN0(i-) | 4,1% | 0%-23% | |||
| b. Okselklierdissectie bij pN0(i+) | 2,3% | 0%-50% | |||
| c. Meer dan 5 schildwachtklieren verwijderd bij pN0(i-) | 2,1% | 0%-17% | |||
| d. Meer dan 5 schildwachtklieren verwijderd bij pN0(i+) | 2,2% | 0%-25% | |||
| Percentage patiënten postoperatief besproken in een multidisciplinair team | |||||
| a. Percentage patiënten dat besproken is* | 97% | 32%-100% | |||
| b. Beschikbaarheid van digitaal verslag voor alle behandelaars* | 96% | 27%-100% | |||
| c. Vermelding in het verslag dat alle benodigde specialismen vertegenwoordigd waren** | 51% | 0%-100% | |||
| Pathologie | Gestandaardiseerde verslaglegging patholoog | ||||
| a. Gestandaardiseerde pathologie verslaglegging | 89% | 47%-100% | |||
| b. Protocollaire verslaglegging in de PALGA protocol module** | 54% | 0%-100% | |||
| Aandeel HER2 positieve bepalingen | |||||
| Percentage positieve bepalingen | 13% | 0%-33% | |||
| Aandeel oestrogeen receptor positieve bepalingen | |||||
| Percentage positieve bepalingen ( ≥ 10% van de tumorcellen) | 86% | 74%-100% | |||
| Aandeel progesteron receptor positieve bepalingen | |||||
| Percentage positieve bepalingen ( ≥ 10% van de tumorcellen) | 71% | 55%-97% | |||
| Aanvullende therapie | Adjuvante chemotherapie bij vroeg stadium mammacarcinoom*** | ||||
| Percentage patiënten dat adjuvante chemotherapie krijgt | 90% | 63%-100% | |||
| Radiotherapie bij lokaal uitgebreid invasief mammacarcinoom*** | |||||
| Percentage patiënten dat radiotherapie krijgt | 82% | 33%-100% | |||
| Radiotherapie bij DCIS na mammasparende behandeling*** | |||||
| Percentage patiënten dat radiotherapie krijgt | 88% | 44%-100% | |||
| Wachttijden | Wachttijd tussen diagnose en aanvang preoperatieve chemotherapie* | ||||
| Patiënten binnen 5 weken na diagnose gestart met neo-adjuvante chemotherapie | 68% | 0%-100% | 29 | (1-412) | |
| Wachttijd tussen diagnose en operatie* | |||||
| Patiënten binnen 5 weken na diagnose geopereerd | 84% | 28%-100% | 22 | (0-394) | |
| Wachttijd tussen laatste operatie en aanvang radiotherapie*** | |||||
| a. Patiënten binnen 5 weken na operatie gestart met radiotherapie | 45% | 11%-85% | 38 | (0-170) | |
| b. Patiënten binnen 6 weken na operatie gestart met radiotherapie | 72% | 25%-96% | 38 | (0-170) | |
| Wachttijd tussen laatste chemotherapie gift en aanvang radiotherapie*** | |||||
| Patiënten binnen 4 weken na chemotherapie gestart met radiotherapie | 49% | 0%-100% | 29 | (2-268) | |
| Wachttijd tussen initiële behandeling en aanvang adjuvante chemotherapie*** | |||||
| a. Patiënten binnen 4 weken na operatie gestart met adjuvante chemotherapie | 46% | 0%-100% | 33 | (0-144) | |
| b. Patiënten binnen 4 weken na radiotherapie gestart met adjuvante chemotherapie | 86% | 48%-100% | 20 | (0-132) | |
| Follow up | Lokaal recidief na mammasparende operatie of ablatieve ingreep** | ||||
| a. Lokaal recidief in ipsilaterale borst na mammasparende operatie (2003-2006) | 2,0% | 0%-5% | |||
| b. Lokaal recidief in ipsilaterale thoraxwand na ablatieve ingreep (2003-2006) | 3,2% | 0%-12% |
Indicatoren
Diagnostiek
Breast Imaging-Reporting and Data System (BI-RADS)
De BI-RADS-classificatie beschrijft in welke mate er op basis van beeldvormend onderzoek een verdenking is op een maligniteit. De classificatie kent een schaal van 1 tot 6, waarbij 1 voor een normaal radiologisch onderzoek staat en 6 een pathologisch bewezen maligniteit betreft. De indicator maakt inzichtelijk of voor alle patiënten een BI-RADS-eindcategorie is vermeld in de radiologische verslaglegging. Door het routinematig toekennen van een BI-RADS-eindcategorie neemt de variabiliteit in de verslaglegging tussen radiologen af4. In Nederland wordt bij bijna iedere patiënt, namelijk bij 98%, gebruik gemaakt van deze classificatie in de verslaglegging.
Preoperatief Multi-Disciplinair Overleg (MDO)
Een wekelijks overleg met de verschillende betrokken disciplines voorafgaand aan de behandeling, draagt bij aan de kwaliteit en zorgvuldigheid van de behandeling van patiënten en aan de kennis en expertise van de behandelaars. Ziekenhuizen scoren dit jaar, net als vorig jaar, hoog op deze prestatie-indicator. De norm van het NABON is vastgesteld op 90% (percentage patiënten dat preoperatief in het MDO is besproken). Dit jaar is er een toename zichtbaar van het aantal patiënten dat preoperatief is besproken naar 96%. Eén ziekenhuis presteert significant onder de norm van 90%. Dit ziekenhuis heeft overigens geen kortere doorlooptijd.
Het tweede onderdeel van deze indicator beschrijft het aantal patiënten van wie een digitaal verslag van het preoperatief MDO beschikbaar is. Daarmee is het verslag voor alle behandelaars op elk moment beschikbaar. Vergeleken met vorig jaar is ook hier een verbetering zichtbaar. Dit komt mogelijk doordat meer ziekenhuizen zijn overgegaan op een elektronisch patiëntendossier, maar het kan ook worden veroorzaakt doordat meer ziekenhuizen daadwerkelijk zijn overgegaan tot het vastleggen van de conclusies van het preoperatieve overleg. De resultaten laten namelijk zien dat enkele (n=7) ziekenhuizen rond de 10% scoren, terwijl het merendeel 100% scoort. Minder volledig is het aantal preoperatieve MDO-verslagen, waarbij beschreven staat welke specialismen aanwezig zijn. Gegevens van de NKR laten zien dat dit in 44% van de verslagen genoteerd is. Hier is dus nog verbetering te behalen.
Neo-adjuvante therapie
Het lokaal uitgebreid mammacarcinoom (T4) wordt gezien als een stadium borstkanker met een slechte prognose. Doordat de huidingroei een adequate chirurgische behandeling compromitteert, worden patiënten met dit stadium bij voorkeur eerst behandeld met neo-adjuvante therapie. Door de tumor voorafgaand aan de operatie te verkleinen en zodoende een radicale resectie beter mogelijk te maken kan neo-adjuvante therapie een verbetering van de lokale situatie geven. Helaas zijn de resultaten van de indicator ‘neo-adjuvante therapie bij klinische T4-tumoren’ op basis van de gegevens over 1 jaar moeilijk te interpreteren, omdat het slechts om 1 tot maximaal 9 patiënten per ziekenhuis gaat.
Neo-adjuvante behandeling wordt, naast patiënten met een klinisch T4-mammacarcinoom, ook gegeven aan patiënten met klinische T2-3 tumoren. De tumor kan bij deze groep patiënten kleiner gemaakt worden met neo-adjuvante therapie, zodat de kans toeneemt dat een patiënt borstsparend geopereerd kan worden. In het hoofdstuk 3 ‘Resultaten’wordt hierop verder ingegaan. Bij patiënten die neo-adjuvante chemotherapie krijgen, is het wenselijk dat patiënten met een indicatie voor postoperatieve radiotherapie vóór de start van neo-adjuvante therapie gezien worden door de radiotherapeut. Er zijn ziekenhuizen waarbij 100% van de patiënten voorafgaand aan de primaire behandeling gezien wordt, er zijn ook ziekenhuizen waarbij niemand vooraf gezien wordt door de radiotherapeut.
Operatie
Radicaliteit
Een radicale excisie van een tumor bij een mammasparende operatie is belangrijk, omdat tumorvrije marges correleren met een lagere kans op terugkeer van de ziekte. De grootte van het geëxcideerde preparaat is een balans tussen cosmetische aspecten en compleetheid van de operatie: een grotere excisie dan noodzakelijk leidt tot een slechter cosmetisch resultaat. Bij een te krappe excisie kan residu tumor achterblijven en dit leidt meestal tot aanvullende operaties. Op basis van het pathologisch onderzoek van het resectiepreparaat wordt het resultaat van de operatie geclassificeerd als: microscopisch radicaal, focaal positieve marges (één of twee foci van kleiner dan 4 mm waar tumor zich in het resectievlak bevindt) of meer dan focaal positieve marges (incomplete excisie)4, 5.
Afhankelijk van de marge wordt besloten tot verdere behandeling. Patiënten met een invasief mammacarcinoom ondergaan alleen een heroperatie indien de tumor meer dan focaal in de snijranden wordt teruggevonden.In Nederland ondergaat een patiënt met focaal positief of meer dan focaal positieve resectiemarge bij een Ductaal Carcinoom in Situ (DCIS) een heroperatie.
De uitkomstindicatoren ‘irradicaliteit na mammasparende operatie voor zowel DCIS als voor invasief carcinoom’ belichten dit aspect. Voor zowel de irradicaliteit bij invasieve tumoren (meer dan focaal irradicaal, figuur 1), als bij DCIS (focaal irradicaal of meer dan focaal irradicaal) ligt het landelijke gemiddelde onder de vastgestelde norm. Bij invasieve tumoren blijft, net als vorig jaar, elk ziekenhuis onder de norm van 20%, met een gemiddeld percentage ‘meer dan focaal positieve snijranden na mammasparende operatie’ van 5,6%.
Bij DCIS is de afwijking in het weefsel minder goed afgrensbaar en uitgebreider dan bij invasief mammacarcinoom. Daarom accepteren we minder irradicaliteit, in die zin dat de snijranden ook focaal vrij moeten zijn. Dat vertaalt zich in een grotere kans op initieel niet-complete excisies. Vandaar dat de norm hiervoor is vastgesteld op 30%. Gemiddeld is 23% van de excisies voor DCIS irradicaal. Dit percentage varieert tussen ziekenhuizen, maar alle ziekenhuizen bevinden zich ruim binnen de betrouwbaarheidsintervallen van deze norm.
Indien het onbekend is of er tumorweefsel is achtergebleven in het resectievlak kan er geen optimaal behandelplan worden opgesteld. De reden voor het onbekend zijn van de radicaliteit kan zijn dat het niet vermeld wordt door de patholoog of dat het niet te bepalen is op het aangeleverde weefsel. Zowel voor invasieve tumoren als voor DCIS is dit percentage ‘radicaliteit onbekend’ in de meeste ziekenhuizen zeer laag (gemiddeld 0,9 en 2,8% voor respectievelijk invasief carcinoom en DCIS).
Okselklierdissecties
De schildwachtklierprocedure is de standaardbehandeling geworden bij patiënten met kleinere tumoren (pathologisch T1-2) en een klinisch tumornegatieve oksel, omdat het significant minder postoperatieve morbiditeit geeft, vergeleken met een okselklierdissectie.
Het eerste gedeelte van de indicator ‘okselklierdissecties bij pathologische N0 status’ omvat het aantal okselklierdissecties bij een operatieve behandeling vanwege een stadium I-II mammacarcinoom. In voorgaande jaren werd een aanzienlijke daling gezien in het percentage okselklierdissecties bij deze groep patiënten. Ook dit jaar zet deze daling door, gemiddeld wordt bij 4,1% van de patiënten met een pathologisch T1-2N0 (pT1-2N0) mammacarcinoom en klinisch negatieve oksel een okselklierdissectie verricht (n=284). Vorig jaar was dit 6,1%.
Een okselklierdissectie bij deze patiëntengroep kan vanwege een aantal redenen zijn uitgevoerd. Een okselklierdissectie is geïndiceerd indien geen schildwachtklier te identificeren is. Daarnaast wordt een okselklierdissectie vaak verricht bij patiënten met multicentrische tumoren en soms bij patiënten met zeer beperkte metastasering in de schildwachtklier (geïsoleerde tumorcellen). Het percentage patiënten bij wie een schildwachtklier wordt gevisualiseerd ligt in grote onderzoeken boven de 95%7. Van de 284 patiënten die een okselklierdissectie hebben ondergaan, hebben 120 patiënten (42%) geen schildwachtklierprocedure ondergaan. Dit suggereert dat de schildwachtklier niet wordt gevisualiseerd of dat er wordt afgezien van een schildwachtklierprocedure vanwege multicentriciteit bij 1,7% van de patiënten met een pT1-2N0 mammacarcinoom (42% van 4%= 1,7%). Voor de patiënten met pT1-2N0 mammacarcinoom waarbij wel een schildwachtklierprocedure wordt verricht (circa 2%) is de reden om een okselklierdissectie te ondergaan onduidelijk. Dit kunnen patiënten met geïsoleerde tumorcellen (pN0(i+)) zijn, bij wie een aanvullende okselklierdissectie is uitgevoerd.
Indien er meer dan vijf klieren worden verwijderd bij een schildwachtklierprocedure moeten vraagtekens worden gezet of er nog wel sprake is geweest van een schildwachtklierprocedure met de daaraan verbonden beperkte morbiditeit of dat er eigenlijk al een (basale) okselklierdissectie is uitgevoerd. Daarom beschrijft het tweede onderdeel van deze indicator het percentage patiënten bij wie meer dan vijf klieren als onderdeel van een schildwachtklierprocedure worden verwijderd in het geval van een pT1-2N0 mammacarcinoom. Dit is gemiddeld bij 2,1% van de patiënten die een schildwachtklierprocedure ondergaan het geval en het percentage varieert tussen 0% (32 ziekenhuizen) en meer dan 10% (2 ziekenhuizen). Deze uitkomst suggereert dat er ziekenhuizen zijn waarbij de schildwachtklierprocedure tot uitgebreidere klierdissecties leidt dan nodig is. Dit gegeven verdient nadere analyse in de toekomst.
Postoperatief MDO
Het postoperatieve MDO scoort beter in vergelijking met vorig jaar; 97% versus 95% van de patiënten wordt besproken. Daarmee wordt ruim voldaan aan de norm. Het ziekenhuis dat laag scoort voor wat betreft het aantal patiënten dat in het preoperatieve MDO wordt besproken scoort hier ook laag (32%). Het aantal patiënten van wie een digitaal verslag beschikbaar was, is ook sterk verbeterd; dat steeg van 85 naar 96%. Het definitieve behandelplan is daarmee anno 2012 bij vrijwel alle patiënten digitaal beschikbaar. Ook hier wordt, net als bij het preoperatieve MDO, in het verslag vaak (51%) niet vermeld welke specialismen (specialisten) aanwezig zijn.
Pathologie
Receptoren
Het pathologisch onderzoek stelt kenmerken van de tumor vast. Aan de hand van deze kenmerken kan het verdere behandelplan worden bepaald. Het is belangrijk dat er geen groot verschil is tussen het percentage hormoonreceptorpositieve tumoren of HER2-tumoren dat wordt gevonden per ziekenhuis. Indien er grote verschillen zijn, moet men zich afvragen of de techniek van de meting wel van voldoende kwaliteit is. Het percentage HER2-receptorpositieve tumoren is gemiddeld 13% van alle invasieve tumoren. De meeste ziekenhuizen bevinden zich binnen de 95% betrouwbaarheidslijnen van dit gemiddelde. De oestrogeen- en progesteron-receptorstatus wordt geclassificeerd op basis van het percentage tumorcellen met een kernaankleuring. Indien gelijk of groter dan 10% wordt er gesproken van een hormoonpositieve (oestrogeen of progesteron) tumor. Voor de oestrogeen- en progesteronpositieve receptoren ligt het gemiddelde percentage op respectievelijk 86 en 71%.
Verslaglegging
Net als bij de radiologische verslaglegging is het belangrijk dat de pathologische gegevens ook worden vastgelegd op een gestandaardiseerde wijze. De items oestrogeen- en progesteronreceptorstatus, HER2-status, gradering, tumorgrootte, resectievlak en aantal positieve lymfeklieren worden gemiddeld bij 89% van de patiënten vastgelegd. Negen ziekenhuizen scoren significant lager dan dit gemiddelde.
Het andere gedeelte van de indicator ‘gestandaardiseerde verslaglegging van de patholoog’ is het aantal patiënten dat wordt ingevoerd in de specifieke Pathologisch Anatomisch Landelijk Geautomatiseerd Archief (PALGA) module. Deze indicator is alleen weergegeven voor ziekenhuizen die gebruik maken van NKR-gegevens, omdat het vermoeden bestaat dat dit item niet correct wordt ingevuld door zelfregistrerende ziekenhuizen. Het percentage patiënten bij wie gebruik is gemaakt van deze PALGA-module is 54%. Dit is een stijging vergeleken met het voorgaande jaar waarbij het percentage 41% was. Ziekenhuizen zijn duidelijk verdeeld; of hun pathologielaboratorium maakt er volledig gebruik van en scoort 100%, of ze maken er geen gebruik van en scoren 0%.
Adjuvante therapie
Chemotherapie
Adjuvante systemische therapie leidt tot langere overleving. In de richtlijn wordt omschreven op basis van welke kenmerken vrouwen in aanmerking komen voor adjuvante chemotherapie en hormonale behandeling4. In de indicatorenset is de indicator ‘percentage patiënten jonger dan 60 jaar met een invasief mammacarcinoom en minimaal één macrometastase dat chemotherapie krijgt’ opgenomen. Bij deze categorie patiënten is de indicatie voor chemotherapie ‘hard’. Patiënten kunnen er echter zelf voor kiezen om geen chemotherapie te ondergaan. Ook kan er sprake zijn van comorbiditeit die bijvoorbeeld meer levensbedreigend is dan de winst van adjuvante chemotherapie of waarbij chemotherapie relatief gecontraïndiceerd is. Dat betekent dat een hoger percentage niet per definitie de beste zorg reflecteert. In de NBCA wordt gezien dat gemiddeld 90% van deze patiënten wordt behandeld met chemotherapie (figuur 2). Bovendien is op basis van de lage aantallen per ziekenhuis in 1 registratiejaar de toevalsvariatie nog groot.
Radiotherapie
Radiotherapie is in principe bij elke mammasparende operatie geïndiceerd. Dit geldt voor zowel DCIS als voor het invasieve mammacarcinoom, omdat daarmee de kans op het ontstaan van terugkeer van de ziekte in de behandelde borst sterk afneemt. De indicator ‘percentage patiënten dat radiotherapie krijgt bij DCIS na borstsparende behandeling’ geeft weer dat gemiddeld 88% van deze groep patiënten radiotherapie krijgt. Overigens is er steeds meer discussie of dit ook altijd het geval zou moeten zijn, met name bij patiënten met een laaggradig DCIS4. In de toekomst zal deze nuancering zijn weerslag hebben op de uitkomst van deze indicator. Ook na een niet-borstsparende operatie vanwege een mammacarcinoom kan er er een indicatie zijn voor radiotherapie. Deze indicatiestelling wordt ingegeven door de kans op het ontstaan van een locoregionaal recidief. Dit laatste wordt bepaald door de leeftijd van de patiënt, kenmerken van de primaire tumor, de aanwezigheid van axillaire metastasering en de mate van radicaliteit van de operatie. De ziekenhuizen laten een gemiddelde zien van 82%, zie figuur 3.
Doorlooptijden
Het beperkt houden van de wachttijd tussen verschillende behandelingen vereist een goede afstemming tussen de betrokken medisch specialisten. Wacht- en doorlooptijden weerspiegelen daarmee de kwaliteit van de logistiek van de zorgketen. Wanneer er een grote variatie is tussen ziekenhuizen kan dit iets zeggen over hoe de processen in dat ziekenhuis georganiseerd zijn. Daarom zijn in de NBCA twee indicatoren voor wachttijden bepaald. De eerste betreft de wachttijd vanaf het bekend zijn van de diagnose tot start therapie. De tweede indicator betreft de wachttijd vanaf een operatie tot het vervolgens starten van de radiotherapie of chemotherapie. Daarbij moet worden opgemerkt dat sommige onderdelen van een behandeling die de kwaliteit van de borstkankerbehandeling beogen te verhogen, tegelijkertijd de wachttijden kunnen verlengen. Een preoperatieve MRI (Magnetic Resonance Imaging)-scan of het uitvoeren van een directe reconstructie bij patiënten die een ablatieve ingreep ondergaan, zijn hier voorbeelden van.
Diagnose tot behandeling
De wachttijd tot de start van een behandeling moet niet te lang zijn, maar het stellen van een absolute grens is arbitrair. Wanneer de diagnose is gesteld in ziekenhuis A, maar de patiënt wordt verwezen en behandeld in ziekenhuis B (verwijscentrum) wordt de tijd berekend vanaf de datum van het eerste consult in het verwijscentrum. De reden hiervoor is dat de wachttijden die aan het verwijscentrum worden toegeschreven anders langer lijken dan ze in werkelijkheid geweest zijn. Van alle patiënten met een invasief mammacarcinoom is de mediane duur vanaf het stellen van de diagnose tot aan een operatieve behandeling 22 dagen. Tien 10 ziekenhuizen scoren significant onder de norm (90% van de patiënten binnen 5 weken geopereerd), bij een hypothetische norm van 7 weken betreft dit 4 ziekenhuizen. In totaal wordt 94% van de patiënten binnen 7 weken geopereerd.
Wanneer wordt gestart met neo-adjuvante chemotherapie is de duur tussen het biopt en de start van de systemische behandeling mediaan 29 dagen.
Voor de initieel chirurgisch behandelde patiënt heeft een preoperatieve MRI-scan en het uitvoeren van een directe reconstructie na ablatieve behandeling een significant verlengend effect op de wachttijd tot een operatie (zie figuur 4) . Patiënten die een preoperatieve MRI-scan krijgen en een directe reconstructie ondergaan wachten twee weken langer tot hun chirurgische ingreep (mediaan 36 in plaats van 21 dagen). Een voor de hand liggende verklaring voor de vertraging in wachttijd bij een directe reconstructie is dat de chirurg en plastisch chirurg beiden beschikbaar moeten zijn.
Wanneer alleen patiënten worden geanalyseerd bij wie preoperatief geen MRI-scan is gemaakt en die geen directe reconstructie ondergingen zijn er zes ziekenhuizen die significant onder de Treeknorm (operatie binnen vijf weken na diagnose) presteren.
Operatie tot adjuvante behandeling
Voor patiënten die adjuvante radiotherapie of chemotherapie ondergaan, is de mediane wachttijd vanaf de operatie tot aan het starten van de daaropvolgende behandeling respectievelijk 38 en 33 dagen. Er is op dit moment (nog) geen norm vastgesteld voor de indicatoren die betrekking hebben op radiotherapie en adjuvante chemotherapie. Gemiddeld start 45% van de patiënten binnen 5 weken met de radiotherapie. Dit percentage loopt op tot 72% binnen 6 weken na de operatie (figuur 5”)). Overigens zijn patiënten die eerst chemotherapie krijgen geëxcludeerd. Wanneer een patiënt eerst postoperatief radiotherapie en daarna chemotherapie krijgt, is de mediane duur tussen deze twee adjuvante behandelingen 20 dagen. Hierbij is 86% binnen 4 weken ná de laatste bestralingssessie met chemotherapie gestart.
Wanneer een patiënt postoperatief eerst adjuvante chemotherapie krijgt, start gemiddeld 46% binnen 4 weken na de operatie. Dit percentage loopt op wanneer de grens wordt verschoven naar 5 (68%) dan wel 6 weken (82%). Wanneer na de chemotherapie radiotherapie volgt, bedraagt de mediane tijd van de adjuvante chemotherapie tot radiotherapie 29 dagen. Gemiddeld werd 49% binnen 4 weken na de laatste chemotherapiekuur bestraald.
Follow-up
Het lokaal recidief van het mammacarcinoom wordt op dit moment nog niet geregistreerd in de NBCA. De reden hiervoor is dat een patiënt gedurende vijf jaar gevolgd moet worden, wat nog niet mogelijk is, omdat de NBCA-registratie pas twee jaar bestaat. De NKR heeft deze gegevens eerder wel vastgelegd voor de uitvraag van indicatoren door Zichtbare Zorg. Een gemiddeld recidiefpercentage van 2,5% binnen vijf jaar wordt gezien bij patiënten die tussen 2003 en 2006 zijn gediagnosticeerd met een vroeg stadium mammacarcinoom. Het percentage lokaal recidief is de afgelopen jaren gedaald van 2,5% in 2003 naar 1,5% in 2006 voor de mammasparende operaties. Na een ablatieve ingreep is dit gedaald van 3,5 naar 2,7% over deze jaren. Lokale controle van het vroeg stadium mammacarcinoom is daarom in Nederland uitzonderlijk goed en verbetert nog steeds. (Zie ook hoofdstuk 4 ‘Lokaal recidief’).
Conclusie
Met de huidige indicatoren streven we naar inzicht in het zorgproces voor de patiënten met borstkanker. Over de gehele linie is te zien dat ziekenhuizen wat betreft uitkomstindicatoren goed scoren.
De resultaten over wachttijden en de verschillen tussen ziekenhuizen wekken de indruk dat “tijdigheid” een complexe indicator is voor het meten van kwaliteit van zorg. De voordelen van het verhogen van de snelheid waarmee een traject wordt doorlopen, dient namelijk steeds in het licht te worden gezien van de indicatie voor additionele onderzoeken of behandelingen. Het stellen van een norm gaat gemakkelijk voorbij aan de nuances die worden ingegeven door een dergelijke afweging. In dit kader is de rol van een audit: het weergeven van de haalbaarheid van een eventuele norm, inzichtelijk maken welke ziekenhuizen afwijken van de gestelde norm en wat de mogelijke oorzaken hiervoor zijn. Sommige indicatoren laten zien dat er een gunstige ontwikkeling in de tijd is, ook zonder een gestelde norm. Blijkbaar werkt auditing als instrument hiervoor heel goed.
Men kan zich afvragen of een indicator waarop elk ziekenhuis goed scoort een indicator moet blijven. Dit zal per indicator wisselen. Zo lijkt de indicator ‘ irradicaliteit na borstsparende operatie’ goed om te blijven meten, maar andere indicatoren, zoals het percentage patiënten dat in het postoperatieve MDO is besproken kan mogelijk op termijn vervallen, omdat het overal goed is. Een ziekenhuisgroep zal daar niet mee stoppen als dat op orde is.
Referenties
1.Resultaten
Summary Samenvatting
- Naast de items die noodzakelijk zijn voor de indicatoren worden in de NABON Breast Cancer Audit ook andere items geregistreerd. Sommige van deze resultaten kunnen in de toekomst gebruikt worden als meting in de kwaliteit van zorg en daarom als indicator.
- Neo-adjuvante therapie kan overwogen worden bij tumoren waarbij tumorverkleining gewenst is en bij locoregionaal uitgebreid mammacarcinoom (cT4). Van de cT4-tumoren ondergaat 70% systemische therapie. Dit geeft bij 82% van de patiënten een tumorreductie naar pathologisch T3 of kleiner. Van de klinische T3-tumoren wordt 20% na neo-adjuvante therapie sparend geopereerd, zonder neo-adjuvante therapie ligt dit percentage aanzienlijk lager: 3%.
- Bij neo-adjuvante therapie is een Magnetic Resonance Imaging (MRI)-scan geïndiceerd in het kader van de analyse van tumorregressie van de behandeling. Een MRI-scan wordt bij 71% van de patiënten voorafgaand aan de start van neo-adjuvante chemotherapie gemaakt.
- Het succes van een mammasparende operatie is bij niet-palpabele tumoren afhankelijk van de radiologische tumorlokalisatie. De meest gebruikte tumorlokalisatie is nog steeds de draadgeleide lokalisatie.
- Het percentage radicale resecties in Nederland is hoog, bij 94% van de invasieve mammacarcinomen die sparend geopereerd zijn, is de resectie microscopisch radicaal.
- Adjuvante therapie wordt grotendeels gebaseerd op de uitslag van de oestrogeen- en progesteron-receptor en de HER2-status. Van belang is daarom dat er geen grote verschillen tussen ziekenhuizen zijn, omdat dit kan wijzen op een onjuiste kleuring van deze receptoren door het pathologie-instituut. Voor de vier receptorcategorieën worden er geen opvallende verschillen gevonden, met uitzondering van één ziekenhuis (relatief minder vaak HER2-negatief, hormoonreceptor-positief).
- Een indicatie voor adjuvante chemotherapie is een tumorpositieve okselklier, maar ook een ongunstige tumor zonder okselkliermetastasen (N0). Bij deze categorieën wordt adjuvante chemotherapie aan 66% van de patiënten gegeven. Anthracyclinen in combinatie met taxanen is de meest gegeven soort chemotherapie (85%). Endocriene therapie wordt gestart bij 68% van de patiënten.
- De compliance voor het toedienen van radiotherapie is hoog; 98% van de sparend behandelde invasieve mammacarcinomen en 88% van de DCIS-tumoren krijgt radiotherapie. Op basis van studies lijkt het toedienen van een ‘boost’ zinvol, het kan echter ook met comorbiditeit gepaard gaan. Het geven van een ‘boost’ zal de komende jaren geëvalueerd moeten worden. Er is een grote variatie tussen radiotherapie-instituten in het geven van een ‘boost’ na mammasparende operatie voor invasief mammacarcinoom, variërend van 35% tot 95%.
Inleiding
In dit hoofdstuk worden de resultaten van de NABON Breast Cancer Audit (NBCA) gepresenteerd. Dit zijn resultaten die in navolging op de benodigde gegevens voor de indicatoren ook in de database zijn opgenomen en waaruit mogelijk nieuwe indicatoren kunnen voortvloeien in de toekomst. In principe zijn gegevens gebruikt over het NBCA-jaar 2012 (1 oktober 2011 tot en met 30 september 2012, n=14.158). Voor de gegevens over adjuvante therapieën zijn gegevens gebruikt van ziekenhuizen die in 2011 patiënten registreerden in de NBCA via de Nederlandse Kankerregistratie (NKR) (n=7.976).
Omdat borstkanker een multidisciplinaire samenwerking vereist komen in dit hoofdstuk de verschillende disciplines aan bod aan de hand van de volgorde in het traject van diagnostiek en behandeling.
Kader definitie
Ductaal carcinoom in situ (DCIS):mammacarcinoom in een zeer vroeg stadium die ontstaat in een melkgang. Het is niet-invasief, wat betekent dat het nog niet groeit buiten de grenzen van de melkgang waarin het is ontstaan.
Invasief carcinoom: mammacarcinoom in een verder gevorderd stadium, waarbij borstkankercellen het omliggende weefsel binnen dringen. Vanaf dat moment wordt de kanker "invasief" of "infiltrerend". Een invasief carcinoom kan een DCIS-component hebben.
Algemene gegevens
In tabel 1 worden de belangrijkste patiënt- en tumorkenmerken getoond, alsmede informatie betreffende diagnostische verrichtingen.
| NBCA-jaar 2011 | NBCA-jaar 2012 | ||||||||
| DCIS | INVASIEF | DCIS | INVASIEF | ||||||
| Aantal | % | Aantal | % | Aantal | % | Aantal | % | ||
| Leeftijd | 59 jaar | 60 jaar | 59 jaar | 61 jaar | |||||
| Geslacht | Vrouw | 1077 | 100% | 7390 | 99% | 1883 | 100% | 12216 | 100% |
| Eerdere chirurgie aan de borst? | Ja | 105 | 7% | 608 | 8% | 142 | 8% | 1024 | 8% |
| Maligniteit ontdekt door screening? | Ja | 662 | 61% | 2702 | 36% | 1215 | 65% | 4973 | 41% |
| Lokaties van histologisch bewezen tumor | Linker mamma | 539 | 50% | 3763 | 51% | 1004 | 53% | 6151 | 50% |
| Rechter mamma | 517 | 48% | 3580 | 48% | 857 | 45% | 5934 | 48% | |
| Beiderzijds | 21 | 2% | 84 | 1% | 24 | 1% | 149 | 1% | |
| Primair occult, links | 1 | 0% | 1 | 0% | 1 | 0% | 2 | 0% | |
| Primair occult, rechts | 2 | 0% | 2 | 0% | 0 | 0% | 4 | 0% | |
| Palpabiliteit van de tumor | Palpabel | 193 | 18% | 4987 | 68% | 355 | 19% | 7897 | 65% |
| Multifocaliteit | Multifocaal | 81 | 8% | 1076 | 15% | 146 | 8% | 1657 | 14% |
| MRI-scan verricht | Ja | 294 | 27% | 2743 | 37% | 622 | 33% | 4585 | 37% |
| BIRADS classificatie | BIRADS 0 | 5 | 1% | 24 | 0% | 3 | 0% | 19 | 0% |
| BIRADS 1 | 7 | 1% | 15 | 0% | 15 | 1% | 21 | 0% | |
| BIRADS 2 | 25 | 3% | 51 | 1% | 42 | 2% | 78 | 1% | |
| BIRADS 3 | 158 | 16% | 387 | 6% | 242 | 14% | 640 | 6% | |
| BIRADS 4 | 727 | 72% | 2944 | 42% | 1282 | 73% | 4803 | 41% | |
| BIRADS 5 | 83 | 8% | 3645 | 52% | 166 | 10% | 6062 | 53% | |
Patiënten met een invasief carcinoom zijn gemiddeld ouder dan patiënten met een ductaal in-situ carcinoom (DCIS) (61 versus 59 jaar). Voor beide groepen is het overgrote deel vrouw (99-100%).
Radiologie
Magnetic Resonance Imaging (MRI)-scan
Bij de diagnostiek van het mammacarcinoom wordt standaard gebruik gemaakt van mammografie en echografie. In toenemende mate wordt tevens gebruik gemaakt van de MRI-scan. In de landelijke richtlijn wordt na het stellen van de diagnose mammacarcinoom middels weefselonderzoek een preoperatieve MRI-scan geadviseerd bij vrouwen die: een mammasparende behandeling overwegen en bij wie er een discrepantie bestaat tussen klinisch en radiologisch onderzoek in tumorgrootte, en/of er sprake is van een invasief lobulair carcinoom1. Dit advies geldt in het bijzonder voor jonge vrouwen. Daarnaast is een preoperatieve MRI-scan geïndiceerd in het kader van analyse van initiële tumorgrootte en beoogde tumorregressie bij neo-adjuvante chemotherapie.
Van alle patiënten met een invasief mammacarcinoom zonder neo-adjuvante therapie in het NBCA-jaar 2012 (n=11.240) wordt bij 34% preoperatief een MRI-scan gemaakt. Dit percentage verschilt sterk tussen ziekenhuizen, variërend van 0,7 % tot 89 % (figuur 1). Gemiddeld wordt bij de helft van de patiënten jonger dan 50 jaar preoperatief een MRI-scan gemaakt. Het betreft in de meeste gevallen patiënten met een klinisch T1- of T2-stadium (90%). Bij 52% van de patiënten met een lobulair mammacarcinoom wordt een MRI-scan gemaakt.
Bij het merendeel van de patiënten dat start met neo-adjuvante chemotherapie (71%) wordt vooraf een MRI-scan gemaakt; ook dit percentage varieert sterk tussen ziekenhuizen (figuur 2).
Uit de huidige data is niet goed op te maken bij hoeveel patiënten de MRI-scan tot een verandering van het initiële beleid heeft geleid: van mammasparende naar ablatieve operatie eventueel aangevuld met bijvoorbeeld neo-adjuvante chemotherapie. Het is op basis van de huidige data dan ook niet mogelijk om te beoordelen of het doen van een MRI-scan bijdraagt aan het verlagen van het percentage irradicale resecties. Bij patiënten met een invasief mammacarcinoom zonder neo-adjuvante therapie bij wie een MRI-scan is gemaakt, is het percentage meer dan focaal irradicale resecties na een mammasparende ingreep respectievelijk 6,8 en 4,3% voor palpabele en niet palpabele tumoren. Indien patiënten geen preoperatieve MRI-scan krijgen is 5,6% van de resecties van een palpabel mammacarcinoom meer dan focaal irradicaal, en 5,2% van de niet palpabele tumoren.
Neo-adjuvante therapie
Neo-adjuvante therapie is geïndiceerd bij het locoregionaal uitgebreid mammacarcinoom (stadium III, waaronder T4). Daarnaast kan neo-adjuvante therapie worden overwogen bij stadium II-mammatumoren, waarbij er tijdens de diagnose al een indicatie is voor systemische therapie en waarbij tumorverkleining gewenst is1. Het percentage patiënten behandeld met neo-adjuvante therapie wisselt sterk per ziekenhuis. Gemiddeld krijgt 8% van alle patiënten met een mammacarcinoom neo-adjuvante therapie. Het grootste deel van deze patiënten krijgt neo-adjuvante chemotherapie (83%). Een klein aantal patiënten krijgt neo-adjuvante hormoontherapie (endocriene therapie). Dit zijn vooral patiënten van 70 jaar en ouder.
Van alle patiënten met een klinisch stadium T4-tumor (cT4) ondergaat 70% neo-adjuvante therapie. Deze therapie bestaat voornamelijk uit chemotherapie. Neo-adjuvante behandeling van een cT4-tumor resulteert bij 82% in een reductie van de tumorgrootte naar een pathologisch stadium T3 (pT3) of lager, en bij 18% in een pT0-tumor.
Het percentage mammasparende chirurgie van patiënten met een cT2-tumor is groter bij patiënten behandeld met neo-adjuvante therapie vergeleken met patiënten zonder neo-adjuvante therapie, respectievelijk 59 en 42%. Voor cT3-tumoren is eenzelfde verschil waarneembaar: 20% van de patiënten behandeld met neo-adjuvante therapie en 3,3% van de patiënten zonder neo-adjuvante therapie ondergaat een mammasparende operatie (figuur 3).
Bij neo-adjuvante endocriene therapie valt op dat tamoxifen nog altijd bij iets minder dan de helft van de patiënten als eerste keus wordt gegeven, namelijk bij 40%. Aromataseremmers hebben neo-adjuvant een iets beter responspercentage dan tamoxifen, wat relevant is voor de keuze van hormonale therapie in postmenopauzale patiënten.
Chirurgische behandeling
Tumor lokalisatie
Een toenemend aantal patiënten, namelijk zo’n 35%, heeft een vorm van borstkanker die niet door de chirurg te voelen is. Het succes van een mammasparende operatie bij deze patiënten is voor een groot deel afhankelijk van de wijze waarop de niet-palpabele tumor preoperatief door de radioloog gelokaliseerd wordt. Het item ‘tumorlokalisatie’ wordt momenteel alleen geregistreerd door de zelfregistrerende ziekenhuizen van de NBCA (n=5.421, 38%). Van dit NBCA-deel van de registratie wordt bij 59% van de patiënten een mammasparende operatie verricht. Van deze patiënten heeft 47% een niet-palpabele tumor (85% van de patiënten met DCIS; 40% van de invasieve mammacarcinomen). Er wordt een lokalisatieprocedure verricht voorafgaand aan de operatie bij 1.145 van de 1.509 patiënten die een niet-palpabele tumor hebben en sparend geopereerd worden.
Verreweg de meest gebruikte lokalisatietechniek is de draadgeleide procedure. Deze techniek wordt gebruikt zowel voor de invasieve mammacarcinomen als bij DCIS in ongeveer 75% van de patiënten met een niet-palpabel mammacarcinoom. Bij de draadgeleide lokalisatie worden echogeleid of stereotactisch (mammografisch) één of meerdere draden ingebracht in of nabij de laesie. De radio-guided occult leasion localisation (ROLL)-techniek wordt voor respectievelijk DCIS en invasieve mammacarcinomen bij 13 en 16% van de patiënten toegepast. Bij het derde type lokalisatieprocedure wordt gebruik gemaakt van een radioactieve I125 bron die door de radioloog in de laesie wordt geplaatst. Bij 6% van de patiënten wordt gebruik gemaakt van deze techniek: bij 7% van de DCIS-tumoren en 5% van de invasieve tumoren. Welke lokalisatietechniek gekozen wordt, hangt niet zo zeer van het type tumor af als wel van de voorkeur voor gebruikte lokalisatietechnieken in het ziekenhuis.
Radicaliteit
In het DICA-rapport 2011 is een hoofdstuk gewijd aan irradicaliteit met hierbij ook uitleg over de te hanteren definities2.
In Nederland wordt bij 61% van de patiënten met een vorm van borstkanker een sparende operatie gedaan (figuur 4); dit percentage verschilt over de jaren weinig. Wel is er verschil in het percentage sparende operaties tussen ziekenhuizen.
Het percentage sparende ingrepen hangt samen met de leeftijd: 53% van de vrouwen onder de 50 jaar ondergaat een sparende ingreep tegen 63% van de vrouwen boven de 50 jaar.
Van de patiënten met een invasief mammacarcinoom wordt 60% primair mammasparend geopereerd.Hiervan is 94% van de resecties radicaal of focaal irradicaal. Van de patiënten met DCIS wordt 67% primair mammasparend geopereerd. Bij 75% van deze patiënten is het gebied van DCIS bij de eerste operatie radicaal verwijderd (tabel 2). Dit is gemiddeld voor beide beter dan de NABON-norm. Het percentage radicaliteit wisselt per ziekenhuis, zoals reeds is beschreven in hoofdstuk 2 ‘Indicatoren’.
| Radicaliteit (eerste operatie) | Tweede operatie | |||
| DCIS (n=1893) waarvoor sparende operatie (n=1274) | Radicaal | |||
| (n=943) 75% | ||||
| Focaal irradicaal | ||||
| (n=179) 14% | Geen operatie | |||
| (n=55) | 4,3% | |||
| Sparend | ||||
| (n=71) | 5,6% | |||
| Ablatio | ||||
| (n=31) | 2,4% | |||
| Onbekend | ||||
| (n=22) | 1,7% | |||
| Meer dan focaal irradicaal | ||||
| (n=116) 9% | Geen operatie | |||
| (n=6) | 0,5% | |||
| Sparend | ||||
| (n=59) | 4,5% | |||
| Ablatio | ||||
| (n=45) | 3,5% | |||
| Onbekend | ||||
| (n=6) | 0,5% | |||
| Onbekend | ||||
| (n=31) 2% | ||||
| Radicaliteit (eerste operatie) | Tweede operatie | |||
| Invasief (n=12241) waarvoor sparende operatie (n=7343) en geen neo-adjuvante therapie (n=6901) | Radicaal | |||
| (n=5794) 84% | ||||
| Focaal irradicaal | ||||
| (n=682) 10% | Geen operatie | |||
| (n=348) | 5,1% | |||
| Sparend | ||||
| (n=109) | 1,6% | |||
| Ablatio | ||||
| (n=75) | 1,1% | |||
| Onbekend | ||||
| (n=150) | 2,2% | |||
| Meer dan focaal irradicaal | ||||
| (n=372) | 5% | Geen operatie | ||
| (n=30) | 0,4% | |||
| Sparend | ||||
| (n=171) | 2,3% | |||
| Ablatio | ||||
| (n=156) | 2,1% | |||
| Onbekend | ||||
| (n=15) | 0,2% | |||
| Onbekend | ||||
| (n=53) | 1% | |||
Bij de patiënten met een niet-palpabele tumor wordt geen significant lager percentage radicale operaties gevonden dan bij de palpabele tumoren. Voor de groep patiënten met een niet-palpabele vorm van borstkanker maakt het qua radicaliteit niet uit welke lokalisatietechniek gekozen is.
In tabel 2 is de vervolgbehandeling bij patiënten met een irradicale resectie weergegeven. Bij een invasief carcinoom wordt focale irradicaliteit gelijk aan ‘radicaal’ geopereerd beschouwd. Er hoeft geen tweede operatie te worden uitgevoerd. Bij de indicator ‘irradicaliteit van het invasieve mammacarcinoom’ wordt daarom van irradicaliteit gesproken indien de tumor meer dan focaal irradicaal verwijderd is. Het is opvallend dat, hoewel in de richtlijn wordt beschreven dat bij een focaal irradicaal geopereerd invasief mammacarcinoom geen heroperatie hoeft plaats te vinden, dit toch gebeurt bij 27% van de patiënten met een focaal irradicale tumor.
Het merendeel van de patiënten met een focaal irradicale resectie bij DCIS (101 van de 177 patiënten) of een meer dan een focaal irradicale resectie bij DCIS (103 van de 114) en een meer dan een focaal irradicale resectie bij invasief carcinoom (239 van de 384) ondergaat een heroperatie (sparend of ablatief).
Uiteindelijk is 61% van de patiënten met DCIS sparend behandeld. Van de 12.240 patiënten met een invasieve tumor is uiteindelijk 57% sparend behandeld.
Wanneer er bij het invasieve mammacarcinoom onderscheid wordt gemaakt tussen ductaal en lobulair carcinoom is het ductaal carcinoom vaker initieel radicaal of focaal irradicaal behandeld (95% versus 87%). Dit bevestigt dat het lobulaire carcinoom lastiger radicaal is te reseceren.
Het percentage radicaliteit of focale irradicaliteit bij invasieve carcinomen die eerst neo-adjuvante chemotherapie hebben gekregen voorafgaand aan de sparende operatie ligt iets lager dan bij patiënten zonder neo-adjuvante chemotherapie, namelijk 90% ten opzichte van 94%. Bij de berekening van de indicator ‘irradicaliteit na mammasparende operatie vanwege invasief mammacarcinoom’ worden patiënten die neo-adjuvante therapie hebben gekregen niet geëxcludeerd. Dit resulteert in een hoger percentage van meer dan focaal irradicale resecties dan dat is weergegeven in tabel 2: 5,6%.
Directe reconstructie
- In de Landelijke richtlijn mammacarcinoom NABON 2.0 februari 2012 staan de volgende aanbevelingen:
- Patiënten die een ablatieve ingreep ondergaan, dienen van tevoren geïnformeerd te worden over de mogelijkheden van mammareconstructie.
- Mammareconstructie moet overwogen worden bij elke patiënt met een mammacarcinoom die ablatief geopereerd wordt.
- Het direct uitvoeren van de mammareconstructie verdient een lichte voorkeur.
Uitzondering op deze laatste aanbeveling zijn de patiënten voor wie een indicatie bestaat voor bestraling na een ablatieve ingreep. De reden hiervoor is dat bestraling van de mammareconstructie leidt tot een grotere kans op complicaties1. Redenen om een mammareconstructie aan alle patiënten aan te bieden zijn van cosmetische en psychosociale aard. Een mammareconstructie leidt in het algemeen tot een hogere patiëntentevredenheid, tot een verbeterd lichaamsbeeld, meer zelfvertrouwen en tot een hogere tevredenheid over het seksueel functioneren en de relatie met de partner1. Ondanks deze aanbevelingen lieten gegevens van 2011 zien dat het percentage directe reconstructies na ablatio relatief laag was (17%). In 2012 is dat aantal niet veranderd; in totaal is bij 17% van de patiënten na een ablatieve ingreep een directe reconstructie verricht. Dit percentage ligt hoger bij de patiënten die een ablatieve ingreep krijgen in verband met DCIS (234 / 624 = 38%) dan bij de patiënten met een invasief mammacarcinoom (696 / 4919 = 14%). Een vooraf ingeschatte mogelijke indicatie voor aanvullende bestraling voor een invasief carcinoom kan een verklaring zijn waarom er mogelijk minder vaak gekozen is voor directe reconstructie (relatieve contra-indicatie) bij het invasieve mammacarcinoom. Een directe reconstructie wordt vaker verricht bij patiënten jonger dan 50 jaar dan bij oudere patiënten (28% vs. 10% bij patiënten met een invasief carcinoom).
Er zijn aanzienlijke verschillen tussen ziekenhuizen in het percentage patiënten dat een directe mammareconstructie krijgt. Voor DCIS varieert het percentage directe reconstructies tussen de 0 en 100% (zie figuur 5a); voor een invasief carcinoom varieert dit tussen 0 en 64% (zie figuur 5b). Er zijn 25 ziekenhuizen waar nooit een directe mammareconstructie wordt uitgevoerd.
Pathologie
De behandelingsstrategie bij borstkanker wordt voor een belangrijk deel gebaseerd op de resultaten van het weefselonderzoek van de primaire tumor en de lymfeklieren. Postoperatief worden in het pathologieverslag gegevens vastgelegd die van belang zijn voor: de evaluatie van de behandeling, de uiteindelijke stadiëring, de inschatting van de prognose en voor het bepalen van de indicatie voor adjuvante systemische behandeling. De belangrijkste pathologische gegevens worden weergegeven in tabel 3. Van het totaal aantal tumoren betrof 13% puur DCIS. Bij patiënten met een DCIS is bij 64% een schildwachtklierbiopsie gedaan. In 1,5% van de schildwachtklieren worden tumorcellen aangetroffen. Bij 1,2% is een okselklierdissectie verricht.
| NBCA-jaar 2012 | |||||
| DCIS | INVASIEF | ||||
| Aantal | % | Aantal | % | ||
| Histologie | Ductaal | 1691 | 95% | 9767 | 82% |
| Lobulair | 4 | 0,2% | 1362 | 11% | |
| Beiden | 39 | 2,2% | 299 | 2,6% | |
| Anders | 48 | 2,6% | 519 | 4,4% | |
| Gradering | Graad I | 265 | 15% | 2803 | 25% |
| Graad II | 650 | 37% | 5296 | 47% | |
| Graad III | 859 | 48% | 3248 | 29% | |
| DCIS component bij invasief mammacarcinoom | Ja | 5806 | 47% | ||
| Diameter van de tumor (in mm) | 23 | 18 | |||
| Oestrogeen receptor status | Positief | 10258 | 84% | ||
| Progesteron receptor status | Positief | 8307 | 68% | ||
| HER2status | Positief | 1482 | 12% | ||
| Pathologisch T-stadium | pTx | 29 | 1,5% | 89 | 0,8% |
| pT0 | 177 | 1,5% | |||
| pTis | 1805 | 96% | |||
| pT1 | 7917 | 65% | |||
| pT2 | 3617 | 30% | |||
| pT3 | 339 | 2,9% | |||
| pT4 | 86 | 0,8% | |||
| Pathologisch N-stadium | pNx | 212 | 11% | 308 | 2,5% |
| pN0 | 1653 | 88% | 7964 | 65% | |
| pN1 | 9 | 0,5% | 2933 | 24% | |
| pN2 | 1 | 0,1% | 658 | 5,4% | |
| pN3 | 1 | 0,1% | 379 | 3,1% | |
Ziekenhuisverschillen bij weefseldiagnostiek
In de klinische praktijk worden tumoren voor systemische therapie verdeeld in vier categorieën:
-
Hormoonreceptor-positieve / HER2-negatieve tumoren
(oestrogeen (ER)+ progesteron (PR)+ HER2- of ER+ PR- HER2- of ER- PR+ HER2-) -
Triple-negatieve tumoren
(ER- PR- HER2-) -
Hormoonreceptor-positieve / HER2-positieve tumoren
(ER+ PR+ HER2+ of ER+ PR- HER2+ of ER- PR+ HER2+) -
Hormoonreceptor-negatieve / HER2-positieve tumoren
(ER- PR- HER2+)
Van de tumoren is 76% een hormoonreceptor-positieve, HER2-negatieve tumor. Een opvallende categorie binnen de hormoonreceptor-positieve tumoren is de ER-negatieve PR-positieve tumor. Expressie van progesteronreceptor staat onder invloed van oestrogenen. Dat betekent dat ER-negatieve PR-positieve tumoren vrijwel niet voor horen te komen. Gemiddeld is 0,4% van de tumoren ER-negatief PR-positief. Er zijn twee ziekenhuizen met meer dan 3% van deze tumoren. Dit kan duiden op een significant verschil in de beoordeling op basis van de kleuringen, maar kan ook duiden op een technisch probleem doordat sommige antilichamen die gebruikt worden bij het onderzoeken van de progesteronreceptor een fout-positieve aankleuring kunnen geven.
Van de tumoren zijn 11% triple-negatieve tumoren. Van de patiënten heeft 12% een HER2-positieve tumor, waarvan 75% hormoonreceptor-positief is. Er zijn geen significante verschillen tussen ziekenhuizen in het gemiddelde percentage van deze vier receptorcategorieën; vrijwel alle ziekenhuizen bevinden zich binnen het 95% betrouwbaarheidsinterval van het gemiddelde (op één na). Figuur 6 is een funnelplot van een hormoonreceptor-positieve, HER2-negatieve tumorverdeling per ziekenhuis.
Lobulaire carcinomen zijn hormoonreceptor-positief in 97% van de patiënten. Ze zijn zelden triple-negatief (2,9%) of hormoonreceptor-negatief/HER2-positief (0,5%).
De graad van de tumor wordt meegewogen in de beslissing om patiënten met een kleine tumor en pN0 adjuvante systemische behandeling te geven. Graad II is de meest voorkomende gradering van het invasieve mammacarcinoom. Ziekenhuizen verschillen niet in het percentage patiënten met ductaal en lobulaire carcinomen, of het percentage patiënten met een graad II-tumor. Voor graad I- en III-tumoren is wel enige spreiding tussen ziekenhuizen zichtbaar.
MammaPrint
De MammaPrint is één van de prognostische genexpressieprofielen waarbij tumoren ingedeeld kunnen worden in een gunstig versus een ongunstig risicoprofiel aangaande (borstkankerspecifieke) overleving1. Volgens de richtlijn kunnen dergelijke gevalideerde genexpressieprofielen gebruikt worden indien er twijfel bestaat over de indicatie voor adjuvante chemotherapie op basis van de traditionele prognostische factoren (leeftijd, grootte van de tumor, aantal positieve lymfeklieren, gradering van de tumor en hormoonreceptorstatus).
In het NBCA-jaar 2012 is bij 2,7% van de patiënten een MammaPrint uitgevoerd (n=336). Bij de helft van deze patiënten wordt een gunstig prognostisch profiel vastgesteld.Het grootste aantal MammaPrints is uitgevoerd bij pN0- (72%), pT1- (75%) en graad II-tumoren (61%). De receptorstatus is overwegend hormoonreceptor-positief / HER2-negatief (87%). Van de patiënten met een hormoonreceptor-positieve / HER2-negatieve pT1N0-tumor heeft 60% met graad I- of graad II-differentiatie, en 22% met graad III-differentiatie, een gunstig profiel op basis van de MammaPrint.
24 van de 25 triple-negatieve tumoren en 14 van de 17 HER2-positieve tumoren hebben een ongunstig profiel. Alhoewel dit erg kleine aantallen zijn, is dit wel in overeenstemming met de literatuur en is er voor deze groep dus geen indicatie voor de MammaPrint3.
Adjuvante systemische therapie
Chemotherapie
Adjuvante systemische therapie heeft als doel om eventueel aanwezige, maar nog niet vastgestelde (micro)metastasen in andere delen van het lichaam te bestrijden1. De kans op aanwezigheid van (micro)metastasen wordt mede bepaald door de lymfeklierstatus van de oksel, pathologische tumorkenmerken en de leeftijd van de patiënt.
Indicaties voor adjuvante chemotherapie zijn tumorpositieve lymfeklieren (N+) of een tumor zonder positieve lymfeklieren (N0) maar wel ongunstige tumorkarakteristieken.
In 2011 onderging 73% van de patiënten met een tumorpositieve lymfeklier (N+) jonger dan 70 jaar adjuvante chemotherapie. Van de patiënten ouder dan 70 onderging 3% adjuvante chemotherapie. Van de patiënten met pN0 en een gunstig Mammaprintprofiel kreeg 8% uiteindelijk toch adjuvante chemotherapie.
Vier patiënten categorieën worden ongunstig N0 genoemd, het percentage patiënten dat chemotherapie krijgt, wisselt tussen deze groepen. Van de patiënten jonger dan 35 jaar met een tumor groter dan 1cm en/of een Bloom and Richardson-gradering hoger dan I krijgt 82% chemotherapie. Van de patiënten tussen 35 en 70 jaar met een tumor van 1 tot 2 cm en graad II of hoger krijgt 56% chemotherapie. Voor tumoren groter dan 2 cm (ongeacht gradering) is dit percentage 66%. Bij patiënten met HER2-overexpressie en een tumor groter of gelijk aan 5 mm kan chemotherapie overwogen worden; 62% krijgt het daadwerkelijk. In alle groepen wordt de meeste patiënten met anthracyclinen in combinatie met taxanen behandeld, zie figuur 7.
HER2-gerichte therapie (Trastuzumab)
De aanwezigheid van HER2-expressie/amplificatie in aanwezigheid van ongunstige tumorkenmerken (pN+ of ongunstig pN0) is een indicatie tot het geven van HER2-gerichte therapie1.
Van de patiënten met een HER2-positieve tumor (n=824) krijgt 62% chemotherapie en 70% HER2-gerichte therapie. Van de patiënten met een indicatie voor adjuvante systemische therapie op basis van tumorkenmerken (pN+ en ongunstig pN0) ongeacht de HER2-status, krijgt 66% chemotherapie en 15% HER2-gerichte therapie. Weinig patiënten krijgen HER2-gerichte therapie zonder chemotherapie (15%).
Hormoontherapie
Indicatie tot het geven van endocriene therapie is een hormoonreceptor-positieve tumor waarbij ongunstige tumorkenmerken (pN+ of ongunstig pN0) aanwezig zijn1.
Adjuvante hormonale therapie wordt gestart bij 68% van de patiënten met een hormoonreceptor-positieve tumor en bij 91% van de patiënten met een hormoonreceptor-positieve tumor met een indicatie voor adjuvante systemische therapie volgens de laatste richtlijn (NABON 2012, nb. cijfers gaan over het jaar 2011).
Naast de harde indicaties die in de richtlijn worden gesteld, spelen vele andere factoren een rol bij de uiteindelijke keuze voor adjuvante therapie. Dit zijn bijvoorbeeld de wens van patiënten zelf, verwachte bijwerkingen en aanwezige comorbiditeit.
Radiotherapie
Mammasparende operatie en radiotherapie
Na een mammasparende operatie wegens (puur) DCIS wordt 88% van de patiënten behandeld met radiotherapie. Bij patiënten met een invasief mammacarcinoom is dit percentage zelfs 98%. Deze resultaten bevestigen dat de algemene landelijke compliance voor het toedienen van radiotherapie opvallend hoog is. Volgens verwachting is dit percentage voor (puur) DCIS iets lager.
Voor zowel het invasieve mammacarcinoom als DCIS is geen verschil zichtbaar wat betreft het geven van radiotherapie tussen ziekenhuizen die al dan niet een radiotherapiefaciliteit in huis hebben (figuur 8). Het grootste deel van de patiënten krijgt bestraling met een boost (59%). Een boost is een extra dosis radiotherapie ter plaatse van het operatiegebied, welke wordt gegeven naast de dosis toegediend op het gehele borstklierweefsel. Er lijkt een duidelijke relatie te bestaan tussen het geven van een boost en oplopende leeftijd: bij invasieve mammacarcinomen wordt bij 79% van de patiënten jonger dan 50 jaar bestraling van de mamma in combinatie met boost gegeven, dit daalt naar 32% voor de patiëntencategorie ouder dan 70 jaar. Voor zowel DCIS als invasieve tumoren daalt het percentage patiënten dat behandeld wordt met een boost naarmate de leeftijd vordert.
“Accelerated Partial Breast Irradiation” (APBI) wordt gegeven in 1% van beidegroepen patiënten. Bij APBI wordt alleen het gebied van de tumor in een versneld tempo bestraald.
Ablatieve ingreep en radiotherapie
Indicaties voor adjuvante radiotherapie na ablatieve chirurgie zijn: een cT4-stadium, een tumorpositief snijvlak en een pN2-stadium. Een relatieve indicatie bestaat bij pT3-tumoren (in combinatie met andere ongunstige tumorkenmerken), bij ongunstige pN0-tumoren en bij pN1-tumoren.
Na een ablatieve ingreep wordt 28% van de patiënten met een mammacarcinoom adjuvant bestraald. Meestal betreft dit bestraling van de thoraxwand in combinatie met regionale bestraling (67%). Bij de pN2-3-tumoren wordt circa 85%, en bij cT4-tumoren 75% van de patiënten bestraald. Vanwege de lage aantallen is een betrouwbare analyse op ziekenhuisniveau niet mogelijk.
Verschillen tussen radiotherapie instituten
Radiotherapiegegevens worden alleen geanalyseerd van de ziekenhuizen die via de NKR registreerden in 2011. In de NBCA-database is op dit moment geen codering naar radiotherapie-instituut. Om een indruk te krijgen van verschillen tussen radiotherapie-instituten zijn ziekenhuizen opnieuw gecodeerd. Er is gekozen om verwijzende ziekenhuizen te koppelen aan het radiotherapie-instituut waarnaar zij de meeste patiënten verwijzen. Van de 21 radiotherapie-instituten is er 1 instituut dat alleen patiënten verwezen krijgt van zelfregistrerende ziekenhuizen. De analyse is daardoor gebaseerd op 20 radiotherapie-instituten. Voorzichtigheid is geboden bij de interpretatie van de resultaten, omdat niet alle ziekenhuizen worden weergegeven.
Er lijkt echter wel een duidelijk verschil tussen de verschillende radiotherapie-instituten te zijn in het percentage patiënten dat na een mammasparende operatie behandeld wordt met een boost voor zowel invasief carcinoom (figuur 9) en DCIS. Bij de sparende behandeling van DCIS is er tussen de instituten een grote variatie bij het toepassen van een boost (varieert van 5 tot 100%). Bij het invasieve mammacarcinoom varieert het percentage boost iets minder sterk, maar nog steeds aanzienlijk: 32 tot 91% (figuur 9). Op basis van de resultaten van de “boost no boost”-studie lijkt het toedienen van een boost bij alle patiënten zinvol4. Bij oudere patiënten is de absolute winst echter beperkt. Bovendien verslechtert het cosmetisch resultaat5. Daarom heeft het Landelijk Platform Radiotherapie Mammacarcinoom (LPRM) in 2011 een document opgesteld met richtlijnen voor het weglaten van de boost. De verwachting is dat steeds meer instituten, bij geselecteerde patiënten, de boost achterwege zullen laten.
De indicator ‘wachttijd chirurgie tot radiotherapie’ laat zien dat gemiddeld 45% en 72% van de instituten er in slaagt de patiënten binnen respectievelijk 5 en 6 weken na de operatie te laten starten met de bestraling (zie hoofdstuk 2). Het ziekenhuisvolume (aantal behandelde mammacarcinoompatiënten per jaar) is niet geassocieerd met de duur van de toegangstijd. Volledigheidshalve dient te worden opgemerkt dat het verkorten van de gebruikelijke intervaltijden tussen de operatie en de start van radiotherapie niet leidt tot betere behandelingsresultaten (lokale tumorcontrole, ziektevrije overleving; overleving).
Referenties
1.Lokaal recidief
Summary Samenvatting
- Optimale lokale controle is een belangrijke uitkomstmaat voor de kwaliteit van zorg van patiënten met een vroeg stadium mammacarcinoom
- De indicator ‘percentage lokaal recidief in de ipsilaterale borst na mammasparende operatie’ en ‘percentage lokaal recidief in de ipsilaterale borst na ablatieve ingreep’ zijn vastgelegd door de Nederlandse Kankerregistratie ten behoeve van de uitvraag van indicatoren door Zichtbare Zorg.
- Gegevens over patiënten die tussen 2003 en 2006 zijn behandeld vanwege een vroeg stadium mammacarcinoom laten een lokaal recidiefpercentage van gemiddeld 2,5% binnen 5 jaar zien.
- Het percentage lokaal recidieven is de afgelopen jaren gedaald; van 2,5% in 2003 naar 1,5% in 2006 na mammasparende operaties en van 3,5% naar 2,7% na ablatieve chirurgie. Er worden geen verschillen tussen de ziekenhuizen gevonden.
- Lokale controle van het vroeg stadium mammacarcinoom is in Nederland uitzonderlijk goed en is afgelopen jaren verder verbeterd.
Eén van de belangrijkste uitkomstmaten voor de kwaliteit van de zorg van patiënten met een vroeg stadium mammacarcinoom (pT1-3, M0) is optimale lokale controle. Daarom is één van de indicatoren in de NBCA “het percentage patiënten met een lokaal of regionaal recidief in de ipsilaterale borst, thoraxwand of oksel”. Op dit moment worden in de NBCA de gegevens vastgelegd van alle patiënten die sinds 2011 zijn gediagnosticeerd. Informatie over de recidieven binnen vijf jaar na de behandeling komt voor deze patiënten pas beschikbaar in 2017. Vanuit de Nederlandse Kankerregistratie (NKR) is dergelijke informatie over lokale terugkeer van de ziekte van patiënten die in het verleden zijn behandeld al wel beschikbaar. Deze gegevens zijn de afgelopen jaren verzameld ten behoeve van de uitvraag van indicatoren door Zichtbare Zorg Ziekenhuizen. Zichtbare Zorg vraagt de indicator ‘het percentage patiënten met een lokaal recidief binnen vijf jaar na de mammasparende therapie of ablatieve chirurgie’1. Voor deze jaarrapportage van de NBCA zijn de gegevens geanalyseerd van alle patiënten die in de periode 2003-2006 in 80 ziekenhuizen in Nederland zijn gediagnosticeerd met een vroeg stadium mammacarcinoom.
Resultaten
De norm voor de indicator “lokaal recidief” is gesteld op maximaal 5% binnen vijf jaar. De indicator wordt apart berekend voor mammasparend geopereerde patiënten en patiënten die een ablatieve operatie hebben ondergaan.
Het geregistreerde percentage lokaal recidieven binnen vijf jaar na de diagnose ligt met gemiddeld 2,5% ruim onder de norm van 5% en is de afgelopen jaren gedaald. In 2003 werd een percentage gerapporteerd van 2,5% na sparende operatie en 3,5% na ablatio; anno 2006 is dit respectievelijk 1,5% en 2,7% (tabel 1).
| Aantal patiënten | Follow up | Aantal events | Percentage lokaal recidief (95% BI) | |
| Mammasparende operatie | ||||
| 2003 | 4.159 | 18.669 | 93 | 2.54 % (2.07 - 3.10) |
| 2004 | 4.334 | 19.269 | 84 | 2.21 % (1.79 - 2.74) |
| 2005 | 4.551 | 20.541 | 68 | 1.68 % (1.33 - 2.13) |
| 2006 | 4.598 | 20.768 | 61 | 1.49 % (1.16 - 1.92) |
| 2003-2006 | 17.642 | 79.248 | 306 | 1.96 % (1.76 - 2.20) |
| Ablatieve ingreep | ||||
| 2003 | 3.646 | 14.767 | 106 | 3.48 % (2.88 - 4.20) |
| 2004 | 3.642 | 14.536 | 110 | 3.71 % (3.08 - 4.46) |
| 2005 | 3.461 | 14.133 | 88 | 3.03 % (2.46 - 3.72) |
| 2006 | 3.601 | 15.003 | 84 | 2.71 % (2.19 - 3.35) |
| 2003-2006 | 14.35 | 58.442 | 388 | 3.23 % (2.92 - 3.56) |
Omdat het aantal patiënten per ziekenhuis per jaar beperkt is en lokaal recidieven niet veel voorkomen, is eerder geconcludeerd dat het niet mogelijk is om verschillen tussen ziekenhuizen zichtbaar te maken op basis van deze indicator2. Door de gegevens over vier jaar samen te voegen, is het mogelijk om grotere volumes per instelling te bekijken, waardoor de invloed van toeval afneemt.
De resultaten zijn weergegeven in funnelplots. Voor de mammasparend behandelde patiënten (figuur 1) blijkt dat de resultaten van alle ziekenhuizen ruim binnen het betrouwbaarheidsinterval van 5% liggen. Na ablatieve chirurgie is er één ziekenhuis dat significant slechter scoort dan de norm (figuur 2). Als we voor dit ziekenhuis naar de afzonderlijke jaren kijken, dan scoort dit ziekenhuis in 2003 en 2004 hoger dan de norm en in 2005 en 2006 binnen de norm.
De waarde van de informatie
De indicator laat geen verschillen zien tussen ziekenhuizen. De informatie is echter van grote waarde. Het laat immers zien dat de lokale controle bij patiënten die werden behandeld voor een mammacarcinoom uitzonderlijk goed is en nog verbetert in de tijd, met name voor mammasparend behandelde patiënten.
Het optreden van een lokaal recidief meet de uitkomst van multidisciplinaire borstkankerzorg. Het blijvend monitoren van deze informatie draagt bij aan de continue evaluatie van de borstkankerzorg in Nederland.
Referenties
1.
Samenvatting DLSA
Op 1 januari 2012 is de Dutch Lung Surgery Audit van start gegaan voor het registreren van patiënten die een longingreep ondergaan in Nederlandse ziekenhuizen. Het doel van deze audit is het inzichtelijk maken van het zorgproces rondom de longchirurgische patiënt en het onderling vergelijken van de belangrijkste uitkomsten tussen ziekenhuizen. Door het terugkoppelen van kwaliteitsindicatoren en andere relevante informatie aan de longchirurgische teams, kunnen de knelpunten in het zorgproces inzichtelijk worden gemaakt en indien nodig worden aangepakt. In een eerste registratiejaar is het belangrijkste doel om de registratie zo breed mogelijk uit te rollen over alle ziekenhuizen waar longchirurgie wordt gedaan. Voor het afgelopen jaar richtte de DLSA zich vooral op de longchirurgen van de Nederlandse Vereniging voor Longchirurgie (NVvL), maar het doel is om ook de Nederlandse cardiothoracaal chirurgen die longchirurgische ingrepen verrichten, te betrekken in de registratie. Zo ontstaat er een volledig en betrouwbaar overzicht van de kwaliteit van de longchirurgie in Nederland.
Volledigheid en betrouwbaarheid
Een betrouwbare registratie is afhankelijk van het verzamelen en analyseren van volledige en correcte gegevens. De volledigheid van de registratie van patiënten die chirurgisch zijn behandeld aan een longcarcinoom, kan worden onderzocht door vergelijkingen met de gegevens verzameld in een parallelle registratie, zoals die van de Nederlandse Kankerregistratie (NKR). Dit jaar zijn de gegevens uit de DLSA 2012 vergeleken met de gegevens van de NKR 2010-2011. Op landelijk niveau lijkt bijna 85% van de voor een longcarcinoom geopereerde patiënten geregistreerd in de DLSA. Naast het hoge aantal patiënten dat ingevoerd is, komen ook de patiënt- en tumorkenmerken in beide registraties in grote mate met elkaar overeen. Een vergelijking van de juistheid van gegevens op patiëntniveau is nog niet gemaakt, maar zal volgend jaar tot de mogelijkheden behoren. In de vergelijking met de NKR, zien we dat voor de items die nodig zijn voor het berekenen van de kwaliteitsindicatoren, het percentage niet ingevulde waarden laag is. Dus voor een eerste registratiejaar kan de start van de DLSA, gezien de volledigheid en betrouwbaarheid, worden beschouwd als succesvol.
De eerste resultaten van de DLSA zijn ook internationaal vergeleken. Door de European Society of Thoracic Surgery wordt een Europese registratie georganiseerd, waarin de resultaten van de longchirurgische zorg vergeleken worden tussen de deelnemende landen. Een belangrijke uitkomst die in deze registratie wordt vergeleken, is de sterfte van patiënten binnen 30 dagen na de ingreep. Nederland behoort tot de best presterende landen met een 30-dagensterfte van 2,6%. In Griekenland is dit 8%, maar in Engeland is de postoperatieve sterfte het laagst met 0,8%. Een belangrijk doel van de DLSA en deelname aan de Europese registratie is om verschillen in patiëntenselectie, zorgprocessen en uitkomsten van de longchirurgie in kaart te brengen en de ‘best practices’ te identificeren die leiden tot de beste uitkomsten voor de patiënt.
Resultaten en ziekenhuisvergelijkingen
In de DLSA 2012 zijn 1.646 patiënten ingevoerd die een longingreep hebben ondergaan vanwege een longcarcinoom. Deze patiënten zijn ingevoerd vanuit 44 van de 46 ziekenhuizen waar, door longchirurgen lid van de NVvL, ingrepen worden verricht.
Het longcarcinoom komt vaker voor bij mannen en naarmate de leeftijd toeneemt, is er ook sprake van een verhoogde kans op het krijgen van een longcarcinoom. In verhouding tot mannen wordt bij vrouwen op een gemiddeld jongere leeftijd een longcarcinoom gediagnosticeerd. De preoperatieve stadiëring van een longcarcinoom is een belangrijk traject om tot de juiste behandeling te komen. Hiervoor hebben de betrokken beroepsgroepen ‘evidence-based’ richtlijnen ontwikkeld. De FDG-PET-scan, een relatief nieuw onderzoek, heeft in de laatste jaren een belangrijke rol verworven in de stadiëring van longcarcinomen. Dat blijkt uit het hoge percentage patiënten dat voorafgaand aan de resectie een FDG-PET-scan heeft ondergaan, namelijk 97%. Bij een derde van de patiënten was er aanvullend onderzoek nodig, omdat er een verdenking was op uitzaaiingen naar de lymfeklieren. Dit gebeurt door middel van een via de slokdarm (EUS) (9,5%) of luchtwegen (EBUS) (16%) uitgevoerde echo, met eventueel een punctie. Ook kan er via een kijkoperatie achter het borstbeen, een mediastinoscopie, onderzoek van de mediastinale klieren plaatsvinden. De meeste longcarcinomen worden verwijderd door een deel van of de gehele long te verwijderen. De lobectomie, resectie van een longkwab, is de meest verrichte resectie (70%) om een longcarcinoom te verwijderen. Een pneumonectomie, resectie van een hele long, vindt plaats bij 8% van de patiënten, maar is een uitgebreide operatie die regelmatig gepaard gaat met ernstige complicaties. Bekend is dat de pneumonectomie rechts een grotere kans op postoperatief overlijden (15%) heeft dan de pneumonectomie links (5,7%), wat bevestigd wordt in de DLSA. Andere veel voorkomende complicaties bij een resectie zijn een longinfectie (pneumonie)( 7%), verlengde luchtlekkage (6,6%) en hartritmestoornissen (4,5%). De bronchopleurale fistel, een ernstige complicatie na grote longingrepen, komt gelukkig weinig voor (0,2%). Het optreden van complicaties is vooral geassocieerd met een slechte longfunctie, zoals een diffusiecapaciteit onder de 80%, wat bij de populatie longkankerpatiënten voorkomt door het vaak jarenlange rookgedrag. Ook een ASA-score van drie of hoger voorspelt het optreden van complicaties.
Kwaliteitsindicatoren
De diagnostiek en behandeling van een longcarcinoom is een complex traject. Om het zorgproces in kaart te brengen wordt er gebruik gemaakt van kwaliteitsindicatoren om de geleverde kwaliteit op verschillende onderdelen van dit traject te meten. Bij de behandeling van een longcarcinoom zijn verschillende specialisten betrokken. Het preoperatieve multidisciplinair overleg (MDO) is derhalve een belangrijk moment in het proces van diagnostiek en behandeling van een patiënt: in de DLSA ligt het gemiddelde percentage pre-operatief op een MDO besproken patiënten rond de 92%.
Naast bovengenoemde indicatoren, die de kwaliteit van het zorgproces en de uitkomsten daarvan meten, staat ook het aantal longingrepen dat een ziekenhuis per jaar verricht in de belangstelling. Het ziekenhuisvolume kan iets zeggen over de aanwezige ervaring, maar een minimaal volume is ook nodig om binnen afzienbare tijd iets over de geleverde kwaliteit te kunnen zeggen. De NVvL stelt eisen aan het minimale aantal anatomische parenchymresecties dat er jaarlijks in een ziekenhuis moet worden verricht, namelijk in totaal 20 pneumonectomiën, lobectomieen of anatomische segmentresecties. De Inspectie voor de Gezondheidszorg (IGZ) en Zichtbare Zorg (ZiZo) hebben deze ‘veldnorm‘ overgenomen. In de DLSA 2012 haalt 84% van de ziekenhuizen dit minimumaantal, maar met de belangrijke kanttekening dat in het eerste jaar van deze registratie een aantal ziekenhuizen mogelijk nog niet alle patiënten heeft ingevoerd. De NVvL zal hiernaar informeren bij deze ziekenhuizen.
In de toekomst wordt door samenwerking van longartsen, radiotherapeuten en thorax- en longchirurgen het hele zorgtraject van patiënten met een longcarcinoom in kaart gebracht. De radiotherapeuten zijn inmiddels gestart met een DICA-registratie voor de kwaliteit van de bestraling van longkankerpatiënten. Maar alle partijen streven er naar te komen tot een multidisciplinaire samenwerking in de registratie van het gehele zorgproces en de uitkomsten van patiënten met longkanker.
VATS versus Thoracotomie
Sinds de introductie van de video-assisted thoracoscopic surgery (VATS) in Nederland heeft deze operatietechniek veel terreinwinst geboekt in de behandeling van patiënten met een longaandoening. Een VATS is een minimaal invasieve operatietechniek, waarbij vooral het niet spreiden van de ribben bij het verkrijgen van toegang tot de borstholte, voordelen heeft ten op zichte van de open techniek, de thoracotomie. Sinds enkele jaren worden ook anatomische resecties, zoals lobectomieën met de VATS-techniek verricht. Dit heeft een grote vlucht genomen. In vergelijking met de Verenigde Staten en andere Europese landen wordt de VATS in Nederland relatief vaak toegepast: een lobectomie wordt in Nederland bij meer dan de helft van de patiënten via VATS verricht. Uit de DLSA 2012 blijkt bovendien dat ook grotere resecties, zoals een pneumonectomie of bilobectomie (resectie van twee longkwabben), in sommige centra via VATS verricht worden. Ondanks dit hoge percentage is er nog een forse spreiding tussen de ziekenhuizen, in het gebruik van deze operatietechniek.
Bij de introductie van de VATS-lobectomieën waren er vragen of longkankerresecties via VATS tot dezelfde oncologische uitkomsten zouden leiden als open resecties. Uit de DLSA blijkt dat de uitkomsten van het pathologisch onderzoek in grote lijnen met elkaar overeen komen. Zo is het aantal lymfeklieren dat na de operatie door de patholoog onderzocht werd vergelijkbaar en is er sprake van een hoger percentage radicale resecties in de VATS-groep. Aan dit laatste ligt echter patiëntenselectie ten grondslag: de meeste patiënten met een gevorderd stadium van de ziekte worden geopereerd via een open benadering (thoracotomie).
Ook de kortetermijnuitkomsten van de VATS in vergelijking tot de thoracotomiegroep zijn vergelijkbaar. De vrees dat grote bloedingen tijdens een VATS-ingreep oncontroleerbaar zijn, blijkt niet terecht. Het percentage grote bloedingen en bloedingen waarvoor een reïnterventie noodzakelijk is, is zelfs minder in de VATS-groep dan de thoracotomiegroep. Ook bij de overige complicaties, waaronder opnameduur en mortaliteit, lijkt de VATS-groep het net iets beter te doen dan de thoracotomiegroep. Ook hier geldt dat er patiëntenselectie aan ten grondslag ligt, maar duidelijk is dat er een snelle, en ook veilige introductie van VATS-lobectomieën in Nederland heeft plaatsgevonden.
Wat doet de longchirurg?
In Nederland zijn er twee groepen specialisten die operaties aan de longen uitvoeren, namelijk de thoraxchirurgen en longchirurgen. Beide specialismen opereren patiënten met een longcarcinoom, waarbij de longchirurgen in 2012 bijna 72% van de in Nederland uitgevoerde longkankerresecties uitvoerden. Dit gebeurde in 44 ziekenhuizen. Eén van de voorwaarden voor certificering als NVvL-longchirurg is dat er in het ziekenhuis meer dan 20 anatomische resecties per jaar verricht worden en dat de individuele longchirurg meer dan 10 van deze operaties per jaar doet. Anatomische resecties, zoals pneumonectomieën, lobectomieën en segmentresecties worden voornamelijk verricht voor de behandeling van longkanker. De werkzaamheden van longchirurgen omvatten echter veel meer. Uit de DLSA blijkt dat 60% van de longoperaties die longchirurgen doen, andere ingrepen betreft dan anatomische resecties. Het gaat dan om wigresecties voor het verwijderen van longuitzaaiingen van andere tumoren (7%), chirurgische behandeling van tumoren in het mediastinum (17%), maar ook veel ingrepen voor goedaardige (benigne) aandoeningen (36%). Veel voorkomende niet-kwaadaardige aandoeningen zijn infecties in de thorax (empyeem) of een klaplong (pneumothorax).
Zo valt een substantieel deel van de werkzaamheden buiten de certificering van de longchirurg. Dit heeft consequenties voor de organisatie van de longchirurgische zorg in Nederland. Wanneer de chirurgische resecties voor longkanker worden gecentraliseerd in een beperkter aantal ziekenhuizen betekent dat verlies van ervaring en expertise in de andere ziekenhuizen, met het verlies van (kwaliteit van) chirurgische zorg voor goedaardige longaandoeningen op deze locaties. Anderzijds geeft een verschuiving van longchirurgische zorg naar een beperkt aantal centra, capaciteitsproblemen in die ziekenhuizen, mede doordat ook een deel van de benigne longchirurgie mee verschuift.
Afsluiting
Het eerste jaar van de DLSA is succesvol van start gegaan. Het aantal ingevoerde patiënten en de landelijke dekking is hoog voor een eerste registratiejaar, wat aangeeft dat er een enorme toewijding is van longchirurgen om hun geopereerde patiënten te registreren. Om het gehele zorgproces van de patiënt in kaart te brengen, is het van groot belang de betrouwbaarheid van ingevoerde patiëntgegevens te waarborgen. Aankomend registratiejaar zal hier de aandacht op gevestigd zijn en daarnaast zal de lymfeklierstadiëring van longcarcinoom gedetailleerder in kaart worden gebracht. Een minstens zo grote uitdaging is om alle disciplines betrokken bij de behandeling van het longcarcinoom en andere longafwijkingen te bundelen in één multidisciplinaire audit. In 2013 zullen naar verwachting belangrijke stappen gezet worden die nodig zijn voor een betrouwbare, multidisciplinaire Dutch Lung Cancer Audit.
Volledigheid en betrouwbaarheid
Summary Samenvatting
- De DLSA is opgezet door de Nederlandse Vereniging voor Longchirurgie (NVvL) voor het registreren van de kwaliteit van het zorgproces voor patiënten die een longresectie ondergaan. Het registreren van patiënten is gestart in januari 2012.
- In het eerste registratiejaar namen 44 van de 46 ziekenhuizen in Nederland waar NVvL chirurgen de longchirurgische zorg verlenen, deel aan de registratie.
- De volledigheid van de DLSA op landelijk niveau is ongeveer 85 procent, wanneer we het aantal geregistreerde patiënten vergelijken met de gegevens van de Nederlandse Kankerregistratie (NKR) 2010-2011. De patiënt- en tumorkarakteristieken komen in grote lijnen met elkaar overeen, wat een goede indicatie geeft van de betrouwbaarheid van de DLSA.
- In een vergelijking op Europees niveau kan de longchirurgie in Nederland zich meten met de beste landen. De hoge kwaliteit van zorg bij patiënten met longcarcinoom resulteert in een relatief lage postoperatieve sterfte van 2,6 procent. Naar verwachting zal de komende jaren dit percentage verder dalen.
In 2012 is de Dutch Lung Surgery Audit (DLSA) van start gegaan met het registreren en terugkoppelen van uitkomsten van patiënten die longchirurgie hebben ondergaan. Van de patiënten waarbij longkanker is gediagnosticeerd kan uiteindelijk 10% worden geopereerd, indien het een bepaalde longtumor (niet-kleincellig longcarcinoom) betreft. In de DLSA worden zowel de primair gediagnosticeerde longtumoren, als de recidieven ingevoerd. Naast longkanker worden er ook andere ingrepen geregistreerd, zoals mediastinumchirurgie, longoperaties in verband met uitzaaiingen in de longen (metastasectomieën) en overige operaties die geen relatie hebben tot kanker, maar wel een substantieel aandeel vormen in de werkzaamheden van de longchirurg.
Een kwaliteitsregistratie als de DLSA wint aan validiteit wanneer de registratie volledig en/of representatief is. Indien de deelnemende ziekenhuizen selectief registreren kan een verkeerd beeld geschetst worden van de patiëntengroep, de behandelingen en de uitkomsten daarvan. Teneinde inzicht te krijgen in de representativiteit van de DLSA werd een vergelijking gemaakt met de gegevens in de Nederlandse Kankerregistratie (NKR). In Nederland wordt de longchirurgie traditioneel verricht door zowel thoraxchirurgen als algemeen chirurgen die zich toegelegd hebben op deze vorm van chirurgie. Ongeveer 28% van de resecties vindt plaats in de 11 ziekenhuizen waar longchirurgie wordt uitgevoerd door thoraxchirurgen. In 42 ziekenhuizen door algemeen chirurgen en in 2 ziekenhuizen door een samenwerkingsverband tussen de 2 specialismen. Over het rapportagejaar 2012 hebben 42 van de 55 ziekenhuizen waar longchirurgie wordt verricht, gegevens van ten minste 5 longchirurgische operaties aangeleverd aan de DLSA (figuur 1).
Methodiek vergelijking
De NKR is een betrouwbare bron van informatie over patiënten gediagnosticeerd met een primair niet-kleincellig longcarcinoom (NSCLC) in Nederland. In de NKR zijn echter geen gegevens beschikbaar over patiënten die werden behandeld voor een recidief carcinoom of voor goedaardige indicaties. Bovendien worden de gegevens van de NKR pas later verzameld en waren de gegevens over 2012 bij het samenstellen van dit rapport nog niet beschikbaar.
Voor de beoordeling van de representativiteit van de gegevens in de DLSA over 2012 werd daarom een vergelijking gemaakt met de gegevens in de NKR over 2010 en 2011, ervan uitgaande dat de verdeling (distributie) van patiënt-, tumor- en behandelingskarakteristieken per jaar slechts geringe verschillen vertonen. Voor deze analyses werden identieke definities en selectiecriteria gehanteerd in beide databases. Exclusiecriteria waren:
- Sublobaire resecties. Ingrepen waarbij minder dan een longkwab (lob) wordt verwijderd, bijvoorbeeld wigresecties en segmentresecties.
- In situ tumoren, benigne aandoeningen en longmetastasen. Deze worden in een volgend hoofdstuk beschreven.
- Zeldzame tumortypes, bijvoorbeeld het sarcomatoïd carcinoom en carcinoïden en tumoren die zelden chirurgische worden behandeld, zoals het kleincellig longcarcinoom.
Indien specifieke informatie ontbrak in de DLSA-database, werden deze registraties niet meegenomen in de berekening van de distributies. Het percentage missende waarden wordt echter wel vermeld in de voetnoot bij de tabellen.
Op basis van NKR-gegevens over 2010 en 2011 wordt voor 2012 een aantal van 1.650 anatomische resecties (pneumonectomieën en lobectomieën) voor primair NSCLC verwacht conform de eerder genoemde selectie. Half februari 2013 waren er 1.406 ingrepen (85%) ingevoerd in de DLSA.
Uitkomstenvergelijking
Tabel 1 toont aan dat de patiënt-, tumor- en behandelingskarakteristieken geregistreerd in de NKR en DLSA goed overeenkomen. Longkanker komt nog steeds vaker voor bij mannen, maar dit zal de komende decennia sterk veranderen. Een aanzienlijk deel van de geopereerde patiënten (35% volgens NKR, 34% volgens DLSA) is 70 jaar of ouder. Leeftijd is een belangrijke risicofactor voor operatiesterfte en speelt een cruciale rol bij casemixcorrecties. Zo mag je verwachten dat de operatiesterfte hoger is in een ziekenhuis waar veel ouderen worden geopereerd.
| NKR 2010-2011 | DLSA 20121 | ||
| Geslacht | Man | 61% | 56% |
| Vrouw | 39% | 44% | |
| Leeftijd | 20 - 59 jaar | 26% | 27% |
| 60 - 69 jaar | 39% | 39% | |
| 70 - 79 jaar | 32% | 30% | |
| > 80 jaar | 3% | 4% | |
| Histologie | Adenocarcinoom | 51% | 60% |
| Plaveiselcelcarcinoom | 40% | 34% | |
| Grootcellig carcinoom | 9% | 6% | |
| Type ingrepen | Lobectomie | 81% | 84% |
| Bilobectomie | 8% | 7% | |
| Pneumonectomie | 11% | 10% | |
| Chemotherapie | Inductie | 6% | 5% |
| Postoperatief | 24% | 23% | |
| Pathologisch stadium2 | Stadium 1A | 28% | 35% |
| Stadium 1B | 22% | 20% | |
| Stadium 2A | 16% | 15% | |
| Stadium 2B | 12% | 11% | |
| Stadium 3A | 13% | 11% | |
| Stadium 3B/4 | 3% | 1% | |
| Status na inductiebehandeling | 6% | 6% |
Longoperaties worden in toenemende mate uitgevoerd via een minimaal invasieve benadering, ook wel VATS (video-assisted thoracic surgery) genoemd, in plaats van de traditionele benadering waarbij de ribben moeten worden gespreid om de borstkas open te maken (thoracotomie). In de periode 2010-2012 nam het aantal lobectomieën dat via VATS werd verricht toe van 22% naar 55% (tabel 2). Bij conversie van minimaal invasief naar open resectie (21% in de periode 2010-2011) werd de ingreep in de analyses van de DLSA geclassificeerd als een open resectie ofwel thoracotomie.
| NKR 2010-2011 | DLSA 2012 | ||
| Tumor uitbreiding1 | Residu (R1/2) | 6,6% | 6,4% |
| Mediastinale klieren (N2/3) | 8,3% | 8,0% | |
| 30 dagen mortaliteit | Lobectomie | 1,5% | 1,5% |
| Bilobectomie | 5,1% | 6,6% | |
| Pneumonectomie links | 2,5% | 5,7% | |
| Pneumonectomie rechts | 10,5% | 14,6% |
De meest voorkomende ingreep is de lobectomie. Een bilobectomie, waarbij twee kwabben van de rechter long worden verwijderd, werd bij 7% van de patiënten uitgevoerd. Een pneumonectomie kent een hoog operatierisico, vooral bij operaties aan de rechterzijde. Het aandeel pneumonectomieën is de afgelopen jaren sterk gedaald en betreft nu nog maar 10% van de ingrepen. Bij 5% van de ingrepen werd de operatie voorafgegaan door inductiechemotherapie en in 23% werd chemotherapie postoperatief gegeven. Bij ongeveer de helft van de patiënten (50% volgens NKR, 55% volgens DLSA) was er sprake van stadium I NSCLC. Bij een stadium I is de tumor kleiner dan 5 centimeter en zijn er geen uitzaaiingen in de lymfklieren gevonden. Het percentage van de patiënten met een stadium I tumor dat vijf jaar overleeft, ligt tussen de 65 tot 70%.
Belangrijke uitkomst van de chirurgische behandeling betreft de constatering of er tumorweefsel is achtergebleven na de operatie en of er uitzaaiingen zijn in de klieren achter het borstbeen (pN2/3) of het mediastinum (tabel 3). De kans hierop is afhankelijk van de kwaliteit en de beoordeling van de voor de operatie uitgevoerde diagnostiek. Tumorpositieve mediastinale klieren worden bij voorkeur voorafgaand aan de operatie gediagnosticeerd door middel van een slokdarm- (EUS) of endobronchiale echo (EBUS), aangevuld met een punctie. Eventueel kan in plaats hiervoor ook een mediastinoscopie, een kijkoperatie achter het borstbeen, met biopten plaatsvinden. Wanneer de tumor in de mediastinale lymfeklieren wordt aangetoond, kan er gekozen worden voor een inductiebehandeling, gevolgd door een operatie of een behandeling met een combinatie van chemotherapie en bestraling zonder operatie.
| NKR 2010 | NKR 2011 | DLSA 2012 | ||
| Lobectomie | 22% | 39% | 56% | |
| Bilobectomie | 10% | 19% | 29% | |
| Pneumonectomie | 2% | 6% | 8% | |
Operatiesterfte is een belangrijke uitkomstmaat voor complexe hoog-risico ingrepen, maar dit risico blijkt opvallend laag voor de longchirurgie in Nederland (2,6%). Resectie van de rechterlong staat bekend als de meest risicovolle procedure (10,6% operatiesterfte volgens NKR, 14,6% volgens DLSA) ofschoon het longvolume aan de rechterkant maar 10% groter is dan links. Kritieke complicaties zoals de bronchopleurale fistels worden echter vooral gezien na rechtszijdige ingrepen.
Internationale vergelijking
De DLSA biedt de mogelijkheid om op landelijk niveau behandelingsstrategieën en de resultaten daarvan te vergelijken tussen ziekenhuizen. Ook kan men uitkomsten vergelijken met een ‘benchmark’, het gemiddelde of een vooraf gestelde norm. Nog interessanter wordt het wanneer we Nederlandse resultaten kunnen spiegelen aan internationale referentiewaarden. In veel landen blijkt de longchirurgie namelijk anders georganiseerd dan in Nederland. Zo adviseert de European Society of Thoracic Surgery (ESTS) een volumenorm van 150 thoracale ingrepen per instelling. In een land als Denemarken (5,5 miljoen inwoners) heeft men de longchirurgie derhalve geconcentreerd in vier ziekenhuizen. Via een landelijke registratie houdt men daar zicht op de resultaten. Ook landen als Spanje en Frankrijk kennen een soortgelijke registratie.
Sinds 2001 onderhoudt de ESTS een Europese registratie voor thoraxchirurgie1. Aan deze registratie wordt meegewerkt door klinieken uit 29 landen. In 2012 bevatte deze database 24.090 operaties voor longkanker [ESTS, 2012]. Uit de analyses blijkt dat er nog grote verschillen bestaan binnen Europa. Zo varieert de operatiesterfte tussen 0,8% in Groot-Brittannië en 8,0% in Griekenland. Deze variatie wordt deels verklaard door de uitgebreidheid van de ingrepen en de daarmee samenhangende resectieratio’s en het percentage patiënten met NSCLC dat een chirurgische resectie ondergaat. Het aandeel pneumonectomieën was bijvoorbeeld 10% in Groot-Brittannië versus 22% in Griekenland. De Franse thoraxchirurgen hebben inmiddels afgesproken om hun data toe te voegen aan de ESTS-database en een soortgelijke procedure is in voorbereiding voor de DLSA.
Conclusie
De resultaten van de DLSA lijken representatief voor de Nederlandse situatie. De stadiumverdeling in de DLSA-database is gunstiger dan verwacht, mogelijk doordat nog niet alle thoraxchirurgische centra participeren. De operatiesterfte is laag in vergelijking met andere Europese landen en dit berust niet op een selectiebias. Door middel van de reeds geplande samenwerking met de internationale database van de European Society For Thoracic Surgery kan dit in de nabije toekomst nader worden onderzocht.
Referenties
1.Resultaten en ziekenhuisvergelijkingen
Summary Samenvatting
- In 2012 zijn er in de DLSA van 1.646 patiënten die geopereerd werden vanwege een longcarcinoom gegevens ingevoerd. Longcarcinoom komt vaker voor bij mannen en naarmate de leeftijd toeneemt, is er een verhoogde kans op het krijgen van longcarcinoom. In verhouding tot mannen, wordt bij vrouwen op een gemiddeld jongere leeftijd longkanker vastgesteld.
- De FDG-PET scan heeft een belangrijke plaats in de stadiering van een longcarcinoom verworven, wat blijkt uit het hoge percentage patiënten dat een FDG-PET scan heeft ondergaan voorafgaand aan de operatie. In een derde van de patiënten werd er aanvullend onderzoek verricht door middel van een EUS, EBUS of een mediastinoscopie, om uitzaaiing naar de mediastinale lymfeklieren uit te sluiten.
- De voornaamste complicaties die ontstaan na een ingreep zijn een pneumonie, verlengde luchtlekkage of hartritmestoornissen. Een bronchopleurale fistel, een ernstige complicatie na grote longresecties, komt weinig voor. Het optreden van complicaties is vooral geassocieerd met een slechte longfunctie, zoals een diffusiecapaciteit (DLCO) onder de 80 procent, of een ASA score van drie of hoger.
- In het eerste jaar van de DLSA toont 84 procent van de deelnemende ziekenhuizen aan, dat ze voldoet aan de minimale volumenorm van 20 long parenchymresecties per jaar. Komend jaar zullen alle ziekenhuizen dit aan moeten kunnen tonen met hun gegevens in de DLSA.
In de DLSA worden alle ingrepen geregistreerd die de longchirurgen in Nederland uitvoeren. Het hoofdstuk resultaten laat een overzicht zien van het zorgproces rondom de patiënt die geopereerd wordt vanwege een longcarcinoom. In het eerste deel worden de patiënt- en tumorkarakteristieken beschreven, vervolgens de preoperatieve diagnostiek met aanvullend de operatie en aansluitend de uitkomsten van de operaties. In de DLSA zijn 1.646 patiënten geregistreerd die in 2012 een resectie van een deel van de longen ondergingen voor de behandeling van een longcarcinoom.
Patiënt- en tumorkarakteristieken
Vanuit wetenschappelijke literatuur is bekend dat longkanker vaker voorkomt bij mannen en dat de kans hierop toeneemt naarmate de leeftijd stijgt. Vrouwen krijgen echter gemiddeld op jongere leeftijd longkanker. Zoals verwacht zien we dit terug in de gegevens van de DLSA 2012 (tabel 1). Resecties werden vaker uitgevoerd bij mannen dan vrouwen, vaker op hogere leeftijd (gemiddeld 65 jaar) en vaak bij patiënten in een matige conditie (24% ASA 3 of hoger). Het betreft vrijwel uitsluitend electieve ingrepen. Acute resecties, noodzakelijk voor bijvoorbeeld een bloeding in de long, zijn zeldzaam.
| n=1618 * | ||||
| < 70 jaar | > 70 jaar | |||
| n | % | n | % | |
| Man | 529 | 49% | 369 | 69% |
| Vrouw | 549 | 51% | 170 | 32% |
| ASA1 | ||||
| I | 255 | 24% | 65 | 13% |
| II | 595 | 57% | 283 | 55% |
| III | 187 | 18% | 161 | 31% |
| IV | 12 | 1,1% | 7 | 1,4% |
| V | 0 | 0,0% | 0 | 0,0% |
| Charlson comorbiditeits index | ||||
| 0 | 427 | 40% | 123 | 23% |
| 1 | 276 | 26% | 143 | 27% |
| 2 | 216 | 20% | 138 | 26% |
| 3 + | 160 | 15% | 135 | 25% |
| FEV12 | ||||
| >80% | 346 | 32% | 153 | 28% |
| <80% | 400 | 37% | 210 | 39% |
| missing | 333 | 21% | 176 | 11% |
| DLCO3 | ||||
| > 80% | 194 | 18% | 124 | 23% |
| < 80% | 541 | 50% | 218 | 40% |
| missing | 344 | 32% | 197 | 37% |
| Urgentie | 21 | 1,9% | 16 | 3,0% |
Tumoren zijn vooral rechts gelokaliseerd en vaker in de bovenkwabben dan in de midden- of onderkwabben (figuur 1).
Preoperatief
Bij een patiënt met een niet-kleincellig longcarcinoom (NSCLC) die in aanmerking komt voor een in opzet curatieve behandeling, wordt een FDG-PET gecombineerd met een diagnostische CT geadviseerd. Het belang van deze beeldvorming is een adequate preoperatieve stadiëring van de tumor, waardoor de optimale behandeling kan worden bepaald. Uit de getallen van de DLSA blijkt dat deze richtlijn in 2012 bij 97% van de patiënten gevolgd werd (tabel 2). Als er op de beeldvorming verdenking bestaat op N2-lymfkliermetastasen (uitzaaiingen in verder gelegen lymfeklieren), of als deze niet kunnen worden uitgesloten, dient een endoscopische ultrasonografie (EUS), endoscopische bronchiale ultrasonografie (EBUS) en zo nodig mediastinoscopie plaats te vinden. Ruim 33% (n=538) van de patiënten onderging ten minste een van de bovengenoemde onderzoeken en zeventien patiënten hebben alle drie de onderzoeken ondergaan.
| n | % | |
| FDG-PET 1 | 1533 | 97% |
| EUS 2 | 141 | 8,6% |
| EBUS 3 | 236 | 14% |
| Mediastinoscopie | 352 | 21% |
| EUS of EBUS of mediastinoscopie | 538 | 33% |
Patiënten met longkanker worden bij voorkeur multidisciplinair besproken, zeker voorafgaand aan een in opzet curatieve resectie. Bij dit multidisciplinair overleg wordt gezamenlijk (minimaal een longarts, chirurg, radiotherapeut, radioloog, nucleair geneeskundige en patholoog) het beleid bepaald. Dit blijkt in de DLSA 2012 bij vrijwel alle patiënten (96%) gebeurd te zijn.
Type resectie
Bij 25 patiënten vond een proefthoracotomie plaats en bleek tijdens de operatie dat de tumor niet te verwijderen was (irresectabel). Bij 186 patiënten vond een beperkte resectie plaats in de vorm van een wigresectie (163 patiënten) of een segmentresectie (23 patiënten) (figuur 2). De reden voor de beperkte resectie is niet in de DLSA geregistreerd, maar reden kan zijn dat de patiënt in een matige conditie verkeerde waardoor een grote resectie teveel risico op postoperatieve complicaties of verlies van de longfunctie zou geven. Ook staat voorafgaand aan de resectie de diagnose niet altijd vast en kan deze mogelijk tijdens de operatie niet verkregen worden door snelonderzoek van het weefsel (vriescoupe).
Een reguliere oncologische resectie, dat wil zeggen minimaal lobectomie met meenemen van N1-klieren en sampling of resectie van N2 klieren, vond plaats bij 1.383 patiënten: bij 1.157 betrof het een lobectomie, bij 91 een bilobectomie en bij 135 patiënten een pneumonectomie.
Naarmate het stadium van de tumor hoger werd, vond vaker een uitgebreidere resectie van het longweefsel plaats (zie figuur 3). Zo is ook te zien dat in de vergevorderde stadia (3B en 4) van een longcarcinoom veel vaker een proefthoracotomie is verricht.
Bij 44 patiënten vond naast de lobectomie ook een sleeve-resectie plaats. Hierdoor werd een uitgebreidere parenchymresectie – bilobectomie of pneumonectomie – voorkomen. Deze sleeve-resecties werden zowel in laag volume als hoog volume ziekenhuizen uitgevoerd. Het percentage uitgevoerde pneumonectomieën is 8,3% (N=135), wat acceptabel is te noemen in vergelijking met de gerapporteerde 7 tot 28% in de literatuur1.
De mortaliteit na een pneumonectomie is 9,4% (n=13) en na een lobectomie, bilobectomie, sleeve-resectie of wigresectie 1,9% (n=24). De aandacht zal dus moeten uitgaan naar het streven zo parenchym sparend mogelijk te opereren.
De geregistreerde parameters laten niet toe een uitspraak te doen over de compleetheid van de lymfkliersampling of lymfeklierdissectie uitgevoerd bij de longresectie. Het datamodel van de DLSA voor 2013 is hiervoor aangepast, zodat volgend jaar meer gedetailleerde informatie ter beschikking komt. Bij 84% van de patiënten bleek de resectie radicaal (R0), bij 5% microscopisch irradicaal (R1) en 2% macroscopisch irradicaal (R2), bij 10% was dit onbekend of niet ingevuld in de registratie. De deelnemers zal komend jaar gewezen worden op het belang van de registratie van deze belangrijke uitkomstparameter.
Het pathologisch stadium werd niet altijd geregistreerd, maar zoals op basis van de richtlijn betreft het vrijwel steeds een Stadium I, II of IIIA. Slechts zelden wordt een stadium IIIB of IV geopereerd.
Postoperatief
Patiënten verbleven mediaan 9 [range 0 – 129] dagen in het ziekenhuis na de operatie. In deze periode werden bij 31% van de patiënten een of meerdere complicaties geregistreerd waarvan dit bij 12% een ernstige complicatie (mortaliteit, een reïnterventie of een ligduur langer dan 14 dagen) betrof. Veel postoperatief voorkomende problemen zijn: langdurige luchtlekkage (108x), pneumonie (116x) en hartritmestoornissen (74x). Vier maal ontstond er een bronchopleurale fistel: een keer na een pneumonectomie, twee keer na een bilobectomie en een keer na een lobectomie (figuur 4). Er kan echter een onderrapportage zijn van deze ernstige complicatie, omdat deze soms pas langere tijd na de operatie ontdekt wordt.
In 2012 betrof de gerapporteerde 30-dagenmortaliteit 2,6% (39 patiënten). Dit komt overeen met de gegevens uit de Europese ESTS-database (zie hoofdstuk 1), die 1 tot 4% mortaliteit rapporteert.
Het optreden van complicaties was niet gerelateerd aan het geslacht, de leeftijd of de Charlson comorbiditeitsscore (figuur 5). Wel is er een verhoogd risico op een gecompliceerd beloop indien de ASA III of hoger is of een verlaagde DLCO onder de 80%. Complicaties werden vaker gezien na een bilobectomie en sleeve-resectie dan na andere resecties, maar de aantallen zijn te klein om statistisch significante verschillen aan te tonen (figuur 6).
Ziekenhuisverschillen
In 15 van de 44 registrerende ziekenhuizen vonden meer dan 50 resecties plaats; in 7 ziekenhuizen vonden minder dan 20 anatomische resecties plaats. Een minimumeis voor certificering is 20 anatomische longresecties (pneumonectomie, lobectomie of segmentresectie) per jaar (figuur 7). Mogelijk hebben ziekenhuizen in hun eerste registratiejaar nog niet alle ingrepen geregistreerd of zijn ziekenhuizen in de loop van het jaar een samenwerkingsverband aangegaan met andere ziekenhuizen. Dit zal door het bestuur van de Nederlandse Vereniging voor Longchirurgie met de betrokken ziekenhuizen worden besproken.
Toekomst
De DLSA is een clinical audit in ontwikkeling. De huidige kwaliteit van de longchirurgie lijkt goed in vergelijking met de resultaten in andere Europese landen. Bovendien wordt de analyse van de kwaliteit van de lymfeklierdissecties mogelijk door verbeterde registratie in 2013. Toch is de registratie nog niet compleet. Ten eerste geldt dit voor het aantal deelnemende ziekenhuizen en het aantal geregistreerde patiënten. We hopen de komende jaren uit te kunnen breiden naar een complete, landelijk dekkende, registratie. Net zo belangrijk is echter de registratie van de gehele behandeling van longkankerpatiënten in Nederland. De DLSA bevat alleen gegevens van patiënten die werden geopereerd. Er blijven daardoor belangrijke vragen liggen: Hoe worden patiënten behandeld die niet in aanmerking komen voor een operatie? Zijn er patiënten die niet geopereerd zijn, maar daar mogelijk toch baat bij hadden kunnen hebben? Antwoord op dergelijke vragen vereist een multidisciplinaire registratie in samenwerking met longartsen en radiotherapeuten. De radiotherapeuten zijn inmiddels gestart met een clinical audit van de radiotherapeutische behandeling van het longcarcinoom. We hopen in de nabije toekomst echter een multidisciplinaire clinical audit te realiseren om zo een beter zicht te krijgen op de kwaliteit van het gehele zorgproces voor alle patiënten met longkanker.
Referenties
1.Kwaliteitsindicatoren
Summary Samenvatting
- De diagnostiek en behandeling van een longcarcinoom is een complex traject, waarbij veel betrokkenheid van verschillende specialisten wordt gevergd. Het preoperatieve multidisciplinaire overleg (MDO) is een belangrijk moment in de diagnostiek en behandeling van longkankerpatiënten: in de DLSA ligt het gemiddelde percentage patiënten besproken op een preoperatief MDO rond de 96 procent.
- Voor de goede behandeling van een longcarcinoom is het van belang dat de patiënt na het stellen van de diagnose op korte termijn wordt geopereerd. De norm van 3 weken werd bij slechts 40 procent van de patiënten behaald. Dit is een verbeterpunt wat aandacht zal krijgen in het komende jaar.
- In de toekomst zal door samenwerking van longartsen, thoraxchirurgen en longchirurgen de kwaliteit van het hele zorgtraject van patiënten met longcarcinoom in kaart worden gebracht. Door multidisciplinaire samenwerking zal de huidige indicatorenset worden uitgebreid, om meer inzicht in het gehele proces en de uitkomsten van de behandeling te verkrijgen.
Richtlijnen
Sinds 2004 is voor het diagnosticeren en behandelen van het niet-kleincellig longcarcinoom een richtlijn ontwikkeld door de NVALT, het IKNL en het CBO1. Deze richtlijn doet een aanbeveling voor de stadiëring van het longcarcinoom en geeft evidence-based behandelingsmogelijkheden. Om inzicht te krijgen in de daadwerkelijke kwaliteit van de zorgketen wordt er gebruik gemaakt van kwaliteitsindicatoren, zodat op vaste tijdstippen een aantal meetpunten is ingebouwd. Op deze manier kan een duidelijk beeld worden verkregen of en waar in het proces de knelpunten zitten en mogelijk verbeteringen kunnen plaatsvinden.
Externe indicatoren
In het kader van de Zichtbare Zorg Ziekenhuizen (ZZZ) hebben de beroepsgroepen van longartsen (NVALT), thoraxchirurgen (NVT) en longchirurgen (NVvH) gezamenlijk “externe” kwaliteitsindicatoren geformuleerd die de keten van zorg voor patiënten met longkanker inzichtelijk kunnen maken.
De kwaliteitsindicatoren die door de beroepsgroepen zijn samengesteld, geven met name inzicht in het zorgproces. Deze procesindicatoren geven niet direct de uitkomst van de patiënt weer, maar meten belangrijke punten tijdens behandeltraject en zijn zodoende belangrijk voor het leveren van goede zorg. In de huidige maatschappelijke discussies rondom de gezondheidszorg komt vaak de term ziekenhuisvolume naar voren. Dit is een maat die aangeeft hoeveel ingrepen van een bepaald type er worden verricht binnen een bepaald centrum. Binnen de longchirurgie is het aantal anatomische resecties in verband met longkanker de maat voor volume. Door de beroepsgroep is een minimum van twintig anatomische resecties per ziekenhuis per jaar vastgesteld, dit is door de IGZ overgenomen als prestatie-indicator. De NVT heeft zelf voor de thoraxchirurgiecentra een norm van vijftig resecties per jaar vastgesteld. De doorlooptijd van de patiënt door het zorgproces in het ziekenhuis is tevens een procesindicator. In tabel 1a is te zien dat de doorlooptijd bestaat uit meerdere onderdelen binnen het zorgtraject. Zo bestaat het eerste deel uit de duur van het diagnosticeren van het longcarcinoom en het tweede deel uit de wachttijd tussen diagnose en de operatie. Binnen de wetenschappelijke commissie van de DLSA is er afgesproken dat het diagnostische traject niet langer dan vier weken in beslag mag nemen en de wachttijd op behandeling niet langer dan drie weken. Deze door de DLSA geformuleerde normen voor doorlooptijden zijn gebaseerd op de door de Signaleringscommissie kanker van KWF kankerbestrijding aangescherpte Treeknormen2 die in 2006 zijn vastgesteld. De andere externe kwaliteitsindicatoren zijn te zien in tabel 1a.
| Tabel 1a. Externe kwaliteitsindicatoren | |
| Volume aantal longparenchymresecties | IGZ |
| Percentage patiënten, dat een resectie ondergaat vanwege primair NSCLC longcarcinoom, waarbij de diagnostiek binnen 28 kalenderdagen na het maken van de eerste afspraak is afgerond. | ZZZ |
| Percentage patiënten, dat een resectie ondergaat vanwege primair longcarcinoom, dat preoperatief in een multidisciplinair team wordt besproken | ZZZ |
| Percentage patiënten, dat een electieve resectie ondergaat vanwege primair NSCLC longcarcinoom, dat besproken is in het MDO, waarbij de chirurgische behandeling binnen 21 kalenderdagen na afronding van de diagnostiek is gestart | ZZZ |
| Tabel 1b. Interne kwaliteitsindicatoren | |
| Percentage patiënten, dat een resectie ondergaat vanwege een T3-T4 longcarcinoom, dat preoperatief een inductiebehandeling heeft gekregen. | |
| Percentage patiënten, dat een mediastinoscopie ondergaat vanwege een primair NSCLC longcarcinoom, waar vijf of meer lymfeklieren zijn verwijderd. | |
| Percentage patiënten, dat een resectie ondergaat vanwege een primair NSCLC longcarcinoom, waar zes of meer lymfeklieren zijn verwijderd bij parenchymresectie. | |
| Verhouding tussen pneumonectomie en parenchymresectie bij patiënten met een primair NSCLC longcarcinoom. | |
| Percentage patiënten, dat een parenchymresectie ondergaat vanwege een primair NSCLC longcarcinoom, dat door middel van een VATS zijn geopereerd. | |
| Percentage patiënten, dat een parenchymresectie ondergaat vanwege een primair NSCLC longcarcinoom, met een ligduur langer dan 14 dagen. | |
| Percentage patiënten, dat een metastasectomie ondergaat, waar postoperatief sprake was van een LHCR graad 3 of 4 complicatie. | |
| Percentage patiënten, dat een parenchymresectie ondergaat vanwege een primair NSCLC longcarcinoom, dat overlijdt binnen 30 dagen na de ingreep. | |
Verderop in dit hoofdstuk worden deze indicatoren weergegeven met de indicatorresultaten uit het eerste registratiejaar. Daarbij wordt er dieper ingegaan op het ziekenhuisvolume, de patiënten die besproken zijn in een preoperatief multidisciplinair overleg en patiënten met een verlengde opnameduur na een operatie in verband met een longcarcinoom.
Interne indicatoren
Naast de externe kwaliteitsindicatoren hebben de longchirurgen ook op eigen initiatief aanvullende kwaliteitsindicatoren samengesteld (tabel 1b). Deze interne indicatoren geven meer informatie over de daadwerkelijke uitkomsten van de chirurgische behandeling van longkanker. Een belangrijke uitkomstmaat is de 30- dagensterfte na een operatie. Deze is gecorrigeerd voor meerdere patiënt- en tumorfactoren (casemixcorrectie) die de zorgzwaarte van de patiënt bepalen. In tabel 2 staan de kwaliteitsindicatoren ingedeeld naar de fase van het zorgproces waarop ze van toepassing zijn. Het is voor het meten van kwaliteit niet mogelijk alle onderdelen van het zorgproces te evalueren. Daarom zijn er, op basis van een Delphi-procedure binnen de wetenschappelijke commissie van de DLSA, essentiële onderdelen van het zorgproces gekozen om te meten. De uitkomsten in de laatste kolom laten de eerste indicatorresultaten, uit de DLSA 2012, op landelijk niveau zien. Ondanks een goed eerste registratiejaar is de informatie mogelijk nog niet voor ieder ziekenhuis volledig, waardoor de uitkomsten nog niet betrouwbaar zijn.
| Zorgproces | DLSA kwaliteitsindicator | Indicatorresultaat | |
| Patiënten | 10.000 patiënten per jaar | ||
| 20% geschikt voor resectie | 1646 patiënten | ||
| Diagnostiek | FDG-PET | 97% preoperatief FDG-PET | |
| Echo-endoscopische beeldvorming | |||
| Mediastinoscopie | |||
| MRI/FDG-PET hersenen bij | |||
| stadium III longtumoren | |||
| Preoperatief MDO | % patiënten preoperatief besproken in MDO | 96% preoperatief MDO | |
| Doorlooptijd diagnostiek | % patiënten binnen 28 dagen diagnostiek rond 1 | ||
| Voorbehandeling | Pre operatief radiotherapie | 1,1% pre operatief radiotherapie | |
| Pre operatief chemotherapie | 5,6% preoperatief chemotherapie | ||
| Operatie | Poli Chirurgie, voorlichting operatie | % patienten behandeld binnen 21 dagen na MDO | 40% < 21 dagen geopereerd |
| Thoracoscopie of thoracotomie | % patienten middels een VATS geopereerd | 56% middels VATS | |
| Type resectie en aanvullende resecties | Verhouding pneumonectomie/parenchymresectie | 1 op de 10 pneumonectomie | |
| Systematische mediastinale lymfeklierdissectie | |||
| Peroperatieve complicaties | |||
| Pathologie | Histologie, graad, radicaliteit van de tumor | % dissectie van >5 lymfeklierstation bij mediastinoscopie1 | |
| Onderzoek lymfeklieren | % dissectie van >6 lymfeklierstations bij parenchymresectie1 | ||
| Postoperatief beloop | Opnameduur | % Opnameduur > 14 dagen na parenchymresectie | 12% langer dan >14 dagen opgenomen |
| Complicaties | % LHCR graad II-IV complicaties bij metastasectomie 1 | ||
| Reinterventie | % sterfte 30 dagen na parenchymresectie | 2,6% mortaliteit |
Indicator: volume anatomische resecties longcarcinoom
In het histogram (figuur 7, hoofdstuk 2) is te zien hoe de aantallen anatomische resecties, geregistreerd in de DLSA, oplopen. Van de 44 ziekenhuizen heeft 75% meer dan 20 pneumonectomieën, lobectomieën of segmentresecties geregistreerd en meer dan 25% haalt zelfs 50 van deze anatomische resecties per jaar. Over de ziekenhuizen die minder dan 20 anatomische resecties hebben geregistreerd, kan niet worden gezegd dat ze ook daadwerkelijk onder de IGZ-norm vallen. Een van de belangrijkste doelen van een eerste registratiejaar van een audit is om zoveel mogelijk ziekenhuizen te laten deelnemen aan de registratie. De jaren daarop zijn nodig om een volledige landelijke dekking van de registratie te krijgen. In dit geval kan het zo zijn dat de ziekenhuizen die onder de 20 resecties zitten in de DLSA, wel degelijk meer resecties hebben verricht maar deze niet hebben geregistreerd. Daarom valt in een eerste registratiejaar nog niet met veel zekerheid te zeggen wat het werkelijke volume van een ziekenhuis is.
Indicator: besproken op preoperatief multidisciplinair overleg
Een multidisciplinair overleg (MDO) is een voorbespreking van een patiënt in een groep met meerdere specialisten om de meest geschikte behandeling en het beste traject voor deze individuele patiënt te kiezen. Binnen een MDO voor patiënten met longkanker zijn longchirurgen, radiotherapeuten, oncologen, radiologen, nucleair geneeskundigen, pathologen en nurse practitioners aanwezig. De basis voor goede integrale zorg voor patiënten met longkanker is optimale samenwerking tussen alle betrokken zorgverleners3. Er is gebleken dat patiënten met longkanker die besproken zijn in een MDO, uiteindelijk een betere primaire behandeling krijgen met een bijpassend nabehandelingstraject, door betere afstemming tussen verschillende behandelaars4. Figuur 1 is een funnelplot waarin alle ziekenhuizen staan met het percentage patiënten dat besproken is in een MDO. Het gemiddelde aantal patiënten dat is besproken is 96%. Alhoewel er geen significante verschillen zijn tussen de ziekenhuizen, zien we in de afbeelding wel een aantal ziekenhuizen die hun patiënten minder vaak bespreken. Er is zelfs een ziekenhuis waarbij geen enkele patiënt is besproken op een MDO. Dit kan wijzen op het feit dat de patiënten niet zijn besproken of dat er geen goede invoer is geweest in deze instelling.
Indicator: opnameduur langer dan 14 dagen bij een parenchymresectie
Het aantal dagen dat een patiënt opgenomen blijft na de longresectie kan worden gezien als een globale graadmeter voor het postoperatieve beloop van de patiënt. Immers, als de patiënt goed herstelt, zonder complicaties, zal deze spoediger het ziekenhuis kunnen verlaten dan patiënten met een gecompliceerd beloop na de operatie. Dit gaat echter niet in alle gevallen op, aangezien er ook andere factoren zijn die de opnameduur kunnen verlengen. Bovendien kan er sprake zijn van verschillen in zorgzwaarte van de patiëntengroepen die in de verschillende ziekenhuizen behandeld worden. In de DLSA ligt 12% (figuur2) van de patiënten met een longresectie langer dan 14 dagen in het ziekenhuis. Op ziekenhuisniveau is er een duidelijke spreiding rondom dit gemiddelde. Er is een aantal ziekenhuizen dat een aanzienlijk kleiner percentage patiënten met een verlengde opnameduur heeft dan de rest van de ziekenhuizen. Omdat het een eerste registratiejaar betreft, kan het zijn dat de registratie nog niet optimaal is of dat de definitie van ‘ontslag’ verschillend wordt geïnterpreteerd. Onduidelijkheid kan bijvoorbeeld ontstaan als het een ontslag van de chirurgische afdeling betreft, maar de patiënt aansluitend opgenomen wordt op de longafdeling. Een scherpe toepassing van definities is daarom essentieel. Bovendien zien we aan de betrouwbaarheidsintervallen in de figuur dat veel variatie op toeval kan berusten. Analyse van gegevens over meerdere registratiejaren zal in de toekomst meer inzicht geven in deze verschillen en mogelijkheden bieden om redenen voor verlengde opnameduur te achterhalen en ‘best practices’ te identificeren.
Indicator: deelname DLSA
Op dit moment is deelname aan de DLSA nog geen prestatie-indicator van de IGZ, maar wel een kwaliteitsnorm van de Nederlandse Vereniging voor Heelkunde.
Als we kwaliteitsindicatoren beoordelen op hun vermogen de kwaliteit van zorg te verbeteren, zou deelname aan het professionele kwaliteitssysteem, de DLSA, in de toekomst weleens de meest effectieve kwaliteitsindicator kunnen blijken te zijn. Het registreren van gegevens over de kwaliteit van de behandeling en de uitkomsten ervan, door zorgverleners zelf, geeft belangrijk inzicht in de kwaliteit van het zorgproces en eventuele verbeterpunten. Naast de landelijk vastgestelde externe indicatoren gerapporteerd in dit hoofdstuk, heeft de beroepsgroep aanvullende indicatoren vastgesteld. Hiermee wil zij nog beter zicht krijgen op de kwaliteit van het zorgproces en zo de zorg voor de patiënten met longkanker optimaliseren. In die context is ‘ziekenhuisvolume’ als kwaliteitsindicator een veel minder effectief instrument en slechts een indirecte maat voor optimale zorgprocessen en uitkomsten van zorg. Voor ‘wachttijden’ geldt dat het een indicator is waar vanuit patiëntenperspectief veel waarde aan gehecht zou kunnen worden. Daaraan zou door de beroepsgroep nog meer aandacht gegeven moeten worden, zeker in deze tijd waarin concentratie van zorg plaatsvindt. Wachttijden hebben echter slechts geringe invloed op de uitkomst van zorg voor deze patiëntenpopulatie. De door de beroepsgroep zelf aangegeven indicatoren hebben directe invloed op de uitkomst van zorg. Minder grote resecties, gebruik van thoracoscopische procedures en betere stadiëring hebben invloed op zowel de behandeling, de kwaliteit van leven, als de overleving van patiënten met longkanker.
Referenties
1.Vats versus Open
Summary Samenvatting
- Sinds de introductie van de video-assisted thoracoscopic surgery (VATS) in Nederland heeft deze minimaal invasieve operatietechniek terrein gewonnen in de behandeling van patiënten met een longaandoening. In vergelijking tot de Verenigde Staten en andere Europese landen wordt de VATS in Nederland relatief vaak toegepast en zal naar verwachting in de komende jaren nog verder toenemen.
- De resectie van een longkwab (lobectomie) werd in 2012 bij meer dan de helft van de patiënten via VATS verricht. Uit de DLSA blijkt dat ook uitgebreidere longresecties, zoals een pneumonectomie of bilobectomie, in sommige centra met een VATS techniek uitgevoerd worden. Ondanks het hoge percentage VATS lobectomieën in Nederland is er een forse spreiding tussen ziekenhuizen in het gebruik van de techniek.
- De resultaten van het pathologisch onderzoek, in de groep patienten die met een VATS techniek zijn geopereerd, komt in grote lijnen overeen met die van de open resecties. Het aantal onderzochte lymfeklieren is vergelijkbaar en is er sprake van meer radicale resecties in de VATS groep. Patiëntenselectie ligt hier aan ten grondslag. Het blijkt dat longtumoren met een hoger stadium vaker worden geopereerd via een open benadering (thoracotomie).
- De korte termijn uitkomsten van de VATS in vergelijking tot de thoracotomie groep zijn vergelijkbaar. Het percentage grote bloedingen en bloedingen waarvoor een re-interventie noodzakelijk is, is niet hoger in de VATS groep. Er blijkt sprake van een brede, maar ook veilige invoering van de VATS techniek in Nederland.
Inleiding
Naast de traditionele open benadering via een thoracotomie, heeft de thoracoscopische benadering in de afgelopen decennia een steeds grotere plaats ingenomen in de chirurgische behandeling van het longcarcinoom. Het achterwege laten van het spreiden van de ribben bij een thoracoscopische resectie, zou het overlijden van de patiënt in veel gevallen kunnen voorkomen. Hoewel in de literatuur artikelen over de voor- en nadelen van beide technieken steeds talrijker worden, lijkt er langzaam een voorkeur te komen voor video-assisted thoracoscopic surgery (VATS) als de te prefereren operatiemethode. Echter, in vrijwel geen enkel land is bekend welk percentage van de resecties van het longcarcinoom via VATS gedaan (kan) worden. In de nationale richtlijn longcarcinoom van 20111 staat nog erg voorzichtig dat VATS in handen van ervaren chirurgen een acceptabele procedure is voor geselecteerde patiënten met een resectabel niet-kleincellig longcarcinoom. Met behulp van de gegevens in de DLSA kunnen we de ervaring van longchirurgen met VATS-technieken nauwgezet monitoren, zodat de techniek veilig en effectief kan worden toegepast.
In 2009 werd in slechts 20% van de academische ziekenhuizen in de Verenigde Staten VATS-lobectomieën verricht, dit in tegenstelling tot Europa waar door de sceptische houding tegen VATS dit percentage nog veel lager zou liggen2.
De schattingen van het percentage VATS-lobectomieën op het totaal van lobectomieën in de VS tijdens de minimal invasive thoracic surgery summit 2011 in Boston, varieerde tussen de 15 en 30%. In de meeste landen in Europa zullen deze percentages waarschijnlijk niet veel hoger zijn, maar ze zijn voor de meeste landen niet bekend. De afgelopen jaren heeft de VATS-techniek in Nederland zich snel verspreid blijkt uit tabel 3 (hoofdstuk 1) en dit lijkt een stuk sneller te zijn gebeurd dan in andere (Europese) landen.
In totaal komen we nu uit op 53% VATS-resecties van het totaal aan parenchymresecties voor het longcarcinoom (figuur 1). In de funnelplot is zichtbaar hoe er een spreiding is in het percentage VATS per ziekenhuis. Hierover hebben we slechts van enkele jaren gegevens en pas van het laatste jaar (2012) hebben we de gedetailleerde gegevens van de DLSA. Daarom zal met het toenemen van de volledigheid van de audit het percentage nog accurater worden. Hopelijk zal door het groeiend aantal registraties in Europese landen, onder andere via de ESTS, ook een internationale vergelijking in de toekomst mogelijk worden.
Demografie
Omdat we de DLSA-gegevens nu nog niet aan langetermijn uitkomsten kunnen koppelen, is een vergelijking van de thoracotomie versus VATS met name interessant om te zien of er aanwijzingen zijn dat bepaalde patiënten geselecteerd worden voor de VATS-behandeling. Ten aanzien van patiëntgerelateerde karakteristieken lijkt dit niet het geval te zijn (tabel 1). Mediane leeftijd, geslacht en comorbiditeit van de patiënten voor de VATS-behandeling lijken niet duidelijk te verschillen. Als we naar ASA3+ en Charlson comorbiditeitsscores kijken zijn deze vergelijkbaar, evenals afzonderlijke pulmonale, cardiale of andere parameters. Alleen de groep met een slechtere longfunctie, FEV1 < 80%, lijkt iets groter in de open geopereerde groep. Op dit moment lijkt het dus nog niet zo te zijn dat de VATS-behandeling meer geschikt wordt geacht voor de oudere patiënten met meer comorbiditeit zoals in de literatuur gesuggereerd3 4. Mogelijk dat in de toekomst voor patiënten die voorheen niet geschikt werden geacht voor chirurgie, vanwege het aanzienlijke trauma van een operatie, wel een VATS-resectie mogelijk wordt geacht.
| Thoracotomie | VATS | |||
| n=742 | 0.47 | n=838 | 0.53 | |
| n | % | n | % | |
| Gemiddelde leeftijd | 64.5 | 64.6 | ||
| Man | 439 | 59% | 438 | 52% |
| ASA 3 + | 186 | 25% | 177 | 21% |
| Mediaan Charlson score | 1 | 1 | ||
| ECOG 0 | 334 | 45% | 410 | 49% |
| ECOG 1 | 201 | 27% | 233 | 28% |
| ECOG 2 | 43 | 5,9% | 43 | 5,1% |
| ECOG 3 | 7 | 1,0% | 4 | 0,5% |
| ECOG 4 | 1 | 0,1% | 0 | 0,0% |
| missings | 156 | 21% | 148 | 17% |
| FEV1 < 80% | 313 | 42% | 286 | 34% |
| missings | 214 | 29% | 282 | 34% |
| DLCO < 80% | 343 | 46% | 394 | 47% |
| missings | 246 | 33% | 285 | |
| Pulmonale comorbiditeit | 264 | 36% | 290 | 35% |
| Cardiale comorbiditeit | 180 | 24% | 205 | 25% |
| Diabetes | 97 | 13% | 98 | 12% |
| Voorgaande thoraxchirurgie | 72 | 9,7% | 48 | 5,7% |
Resecties
Het soort verrichtingen verschilt duidelijk per techniek; naarmate de complexiteit van de ingreep groter wordt neemt de kans op een open resectie sterk toe (tabel 2).Het aantal pneumonectomieën met VATS is nog zeer gering (1,4% versus 15,4%). Dit zou vanwege de technisch moeilijkheidsgraad kunnen zijn. Meer aannemelijk is het dat het met VATS lastig is het resectievlak te bepalen bij centrale doorgroei en te beoordelen of het mogelijk is om een sleeve-resectie in plaats van een pneumonectomie te doen. In de huidige registratie was nog geen mogelijkheid om de reden aan te geven voor conversie of voor primair open starten. Voor de toekomst zou het interessant kunnen zijn om van te voren aan te kunnen geven of er sprake is van een verwachte of een onverwachte conversie en wat de reden voor de conversie was. Er zijn klinieken waar iedereen primair een VATS krijgt, ook al wordt op voorhand op basis van de grootte of ligging van de tumor de kans op conversie zeer groot geacht. Als hiermee maar eenmaal per jaar een onnodige thoracotomie, bijvoorbeeld op basis van maligne pleuravocht/metastasering, voorkomen kan worden, is dit al zeer de moeite waard. Het relatief grote aantal wigresecties in de VATS-groep (14,9% versus 4,7%) heeft hoogst waarschijnlijk te maken met de overweging dat patiënten met een zeer slechte longfunctie die geen thoracotomie aan kunnen nog wel geschikt kunnen zijn voor een minimaal invasieve resectie Zijdigheid lijkt geen rol te spelen bij de keuze voor VATS of de open procedure.
| Thoracotomie | VATS | |||
| n=742 | 0.47 | n=838 | 0.53 | |
| n | % | n | % | |
| Urgent | 11 | 1.5% | 24 | 2.9% |
| Zijde Links | 298 | 40.2% | 347 | 41.4% |
| Zijde Rechts | 440 | 59.8% | 488 | 58.2% |
| Benadering | ||||
| Pneumonectomie | 119 | 16.0% | 11 | 1.3% |
| Bilobectomie | 61 | 8.2% | 26 | 3.1% |
| Lobectomie | 480 | 64.7% | 650 | 77.6% |
| Segmentresectie | 10 | 1.3% | 12 | 1.4% |
| Wigresectie | 37 | 5.0% | 122 | 14.6% |
| Totaal | 742 | 838 | ||
Pathologische uitkomst
Critici hebben wel eens vraagtekens gezet bij het oncologisch resultaat van resecties via VATS. De lymfeklierdissectie zou minder compleet kunnen zijn en ook het verwijderen van het longweefsel via een kleine opening in de thorax zou tot een slechtere pathologische beoordeling kunnen leiden. De eerste resultaten van de DLSA geven geen aanleiding om te vrezen voor een slechtere oncologische uitkomst bij VATS-resecties (tabel 3). Het percentage radicale resecties is zeker niet minder en zoals uit literatuur bekend wordt er geen verschil tussen lymfeklierdissectie middels VATS of een open procedure aangetoond5. Hierbij dient wel aangetekend te worden dat de mogelijkheid tot registratie van uitgebreidheid van de dissectie in 2012 nog beperkt was. In 2013 is deze registratie uitgebreid en kunnen eventuele verschillen tussen de technieken beter onderzocht worden.
| Thoracotomie | VATS | p | |||
| n | % | n | % | ||
| Lymfeklieren, mediaan | 4 [0-18] | 4 [0-18] | |||
| N2 lymfeklieren, gemiddeld 1 | 2.55 | 2.62 | |||
| N2 lymfeklieren, mediaan | 2 [0-9] | 3 [0-9] | |||
| Pathologisch Stadium 2 | p >0,05 | ||||
| Stadium 0/X | 26 | 3.5% | 61 | 6,1% | |
| Stadium IA | 168 | 27% | 302 | 36% | |
| Stadium IB | 113 | 15% | 151 | 18% | |
| Stadium IIA | 124 | 17% | 75 | 8,9% | |
| Stadium IIB | 103 | 14% | 44 | 5,3% | |
| Stadium IIIA | 90 | 12% | 65 | 7,8% | |
| Stadium IIIB | 3 | 0,4% | 2 | 0,2% | |
| Stadium IV | 8 | 1,1% | 12 | 1,4% | |
| R0 resectie 3 | 609 | 82% | 739 | 88% | p >0,05 |
| R1 resectie | 54 | 7,3% | 17 | 2,0% | |
| R2 resectie | 18 | 2,4% | 10 | 1,2% | |
| Histologie | p >0,05 | ||||
| Adenocarcinoma | 309 | 42% | 427 | 51% | |
| Plaveiselcelcarcinoom | 238 | 32% | 174 | 21% | |
Het belangrijkste is de uiteindelijke stadiëring na pathologisch onderzoek. In de VATS-groep zijn de lagere stadia oververtegenwoordigd. VATS is bij uitstek een techniek die geschikt is voor kleinere tumoren, maar het zou goed kunnen zijn dat we hier voor een deel nog naar de leercurve van longchirurgen kijken en dat in de toekomst ook steeds meer complexere pathologie in aanmerking komt voor VATS-benadering. Het relatief grote aantal Stadium 0/X betreft waarschijnlijk zeer kleine tumoren waarbij preoperatief geen diagnose is gesteld. Deze komen in aanmerking voor VATS-diagnostiek met vriescoupe, al dan niet gevolgd door een lobectomie bij bewezen maligniteit.
Voor het aantal R0-resecties zal waarschijnlijk eenzelfde verklaring gezocht moeten worden. Het significant grotere aantal R0-resecties houdt waarschijnlijk gelijke tred met de lagere stadiumstratificaties. Interessant voor de toekomst zou nog een subgroepanalyse kunnen zijn van de R1-resecties in de open groep. Wat gemonitord moet worden is of bij een toename van VATS-operaties bij een gevorderd longcarcinoom het aantal R1-resecties in de VATS-groep navenant omhoog gaat. Of blijven een gevorderde tumor of forse hilaire lymfeklieren toch een reden voor conversie?
Kortetermijnuitkomsten
De kortetermijnuitkomsten in tabel 4 passen in de literatuur waar een steeds groter aantal artikelen is te vinden dat de kortetermijnvoordelen van VATS bepleit 2, 3, 4, 5, 6. De conversies van VATS naar een open procedure zijn, zoals eerder benoemd, in het eerste jaar niet geregistreerd. Dit kan een vertekend beeld geven van de kortetermijncomplicaties.
| Thoracotomie | VATS | p | ||||
| n=742 | 0.47 | n=838 | 0.53 | |||
| n | % | n | % | |||
| 30-dagen mortaliteit | 23 | 3.1% | 13 | 1.6% | ||
| Opnameduur, mediaan | 8 | [0-70] | 6 | [0-129] | ||
| Opnameduur, gemiddeld | 10 | 6 | ||||
| Extra dagen ICU, mediaan | 1 | [0-50] | 1 | [0-41] | ||
| Extra dagen ICU, gemiddeld | 2 | 1 | ||||
| Bloedverlies 1 | p > 0,05 | |||||
| 0 - 500cc | 595 | 84% | 743 | 89% | ||
| 500 - 1000 cc | 65 | 9,1% | 56 | 6,8% | ||
| > 1000 cc | 51 | 7,2% | 28 | 3,4% | ||
| Nabloeding waarvoor reïnterventie | 20 | 2,7% | 9 | 1,1% | ||
| Pulmonale complicaties | ns | |||||
| Pneumothorax | 27 | 3,6% | 28 | 3,3% | ||
| Luchtlek > 5 dagen | 48 | 6,5% | 59 | 7,0% | ||
| Pneumonie | 57 | 7,7% | 54 | 6,4% | ||
| Empyeem | 16 | 2,2% | 12 | 1,4% | ||
| Atelectase | 31 | 4,2% | 15 | 1,8% | ||
| Respiratoir falen | 26 | 3,5% | 24 | 2,9% | ||
| Cardiale complicaties | ns | |||||
| Supraventriculaire ritmestoornis | 40 | 5,4% | 24 | 2,9% | ||
| Ventriculair ritmestoornis | 4 | 0,5% | 4 | 0,5% | ||
| Myocard ischaemie | 7 | 0,9% | 5 | 0,6% | ||
| Trombose complicaties | ns | |||||
| DVT | 0 | 0,0% | 1 | 0,1% | ||
| Longembolie | 2 | 0,3% | 5 | 0,6% | ||
| TIA/CVA | 4 | 0,5% | 4 | 0,5% | ||
| Gecompliceerd beloop | 90 | 12,0% | 80 | 9,5% | ns | |
| Reinterventie | 38 | 5,1% | 36 | 4,2% | ||
Zowel de verlengde opnameduurduur op de IC (gemiddeld 2 dagen versus 1 dag ) als de totale opnameduur in het ziekenhuis (10 versus 6 dagen) lijken passend bij de literatuur ten gunste van de VATS. Een van de grote tegenargumenten tegen de VATS was lange tijd de angst voor een massale bloeding tijdens de operatie en de onmogelijkheid om die snel en effectief te stelpen. Vooralsnog lijkt het bloedverlies niet significant hoger in de VATS-groep en voor de groep > 1 liter bloedverlies lijkt de open groep zelfs iets groter. Ook dit kan echter te maken hebben met de hogere tumorstadia in de open groep. De pulmonale complicaties in beide groepen zijn vergelijkbaar evenals de trombotische complicaties. Het aantal cardiale complicaties in de open groep, met name ritmestoornissen al dan niet supraventriculair, lijkt significant te verschillen van de VATS.
Conclusie
Het eerste registratiejaar van de chirurgische technieken in de DLSA levert een schat aan informatie op waarbij er uiteraard nog geen langetermijnresultaten bekend zijn. De kortetermijnresultaten, illustratief voor de veiligheid van de techniek, zijn zeer goed te noemen. De introductie van de nieuwe techniek heeft het percentage complicaties niet doen toenemen. Internationaal gezien lijken de Nederlandse longchirurgen een enorm snelle leercurve door te maken. De wijze waarop de voorlopers in deze techniek hun collega longchirurgen hebben geholpen om zich de techniek eigen te maken, zou hier aan ten grondslag kunnen liggen. Ondanks het gebrek aan accurate spiegelinformatie, lijken we zover bekend in drie jaar een van de hoogste VATS-percentages in de wereld te hebben verkregen. Of dit slechts toevallig samenvalt met de inspanning van de afgelopen jaren om de longchirurgie steeds verder te centraliseren/optimaliseren, wordt uit deze registratie nog niet duidelijk. Enige samenhang zou echter wel vermoed mogen worden. Als kanttekening moet natuurlijk, zoals al eerder in het rapport gesteld, vermeld worden dat de registratie nog niet volledig is en dat er nog een vertekening in het beeld zou kunnen ontstaan als de ziekenhuizen die nog niet (volledig) registreren een duidelijk lager percentage VATS zouden opereren. Hier krijgen we hopelijk meer inzicht in naarmate de registratie in de toekomst vollediger wordt.
Referenties
1.Wat doet de longchirurg
Summary Samenvatting
- In Nederland zijn er twee groepen chirurgen die operaties aan de longen uitvoeren, namelijk cardiothoracaal chirurgen en longchirurgen. Beide specialismen opereren patiënten met een longcarcinoom, zo opereerden de longchirurgen in 2012 bijna 72 procent van de patiënten met een longcarcinoom in Nederland, in 44 ziekenhuizen.
- Voor de certificering van een longchirurg is het een vereiste dat hij/zij een minimum van 10 longparenchym resecties per jaar verricht. De werkzaamheden van de longchirurg zijn echter veel breder. Naast longparenchym resecties, bestaat 60 procent van de operaties uitgevoerd door longchirurgen uit de chirurgische behandeling van longmetastasen, mediastinale chirurgie en ingrepen aan de longen, longvliezen of thorax, vanwege een benigne oorzaak. Veel voorkomende benigne aandoeningen zijn infecties in de thorax (empyeem) of een klaplong (pneumothorax).
- Uit de DLSA 2012 blijkt dat er in een aantal ziekenhuizen krap 20 longparenchym resecties per jaar worden verricht, maar er een aanzienlijk aantal patiënten met een benigne aandoening worden behandeld. Zo valt een substantieel deel van de werkzaamheden van de longchirurg buiten de certificering van de NVvL.
Chirurgie aan de longen wordt in Nederland door twee type specialisten gedaan. De cardiothoracale chirurg heeft als belangrijkste aandachtsgebied het hart en de longen. Zij opereren in tien centra verspreid over Nederland. De longchirurg, een algemeen chirurg met longchirurgie als specialisatie, doet in principe geen cardiovasculaire ingrepen, maar wel alle operaties indien het de thorax, longen, longvliezen (pleura) en het mediastinum betreft. Zo opereerden de longchirurgen in 2012 bijna 72% van de patiënten met een longcarcinoom, in 44 centra in Nederland.
Dat deze twee specialismen dezelfde ingrepen verrichten, heeft de oorsprong vlak na de Tweede Wereldoorlog1. Door technische ontwikkelingen, verbeterde anesthesie en postoperatieve zorg werd het mogelijk om hartchirurgie te bedrijven. De tweedeling longchirurgie en cardiothoracale chirurgie komt voort uit deze ontwikkelingen, waardoor superspecialisatie ontstond van een groep longchirurgen met een speciale interesse in de hartchirurgie. In de jaren ’70 werd afgesproken, aangezien alleen hartchirurgie te beperkt was voor een chirurg, dat er ook longchirurgie bij gedaan werd en een nieuw specialisme van cardiothoracaal chirurg was ontstaan.
De ingrepen vanwege een longcarcinoom tellen mee voor de normering van het instituut of certificering van de individuele chirurg. Echter, een groot deel van de ingrepen die wordt gedaan door de longchirurg, valt buiten deze groep (figuur 1).
In de figuur is zichtbaar welk type ingrepen er over 2012 werden geregistreerd in de DLSA. Zo blijkt dat 704 operaties zijn gedaan aan het mediastinum, waarvan het grootste aantal ingrepen wordt gedaan ter stadiëring van een niet kleincellig longcarcinoom (NSCLC) via mediastinoscopie (62%) en slechts 8% wordt gedaan vanwege een primaire mediastinale tumor. Metastasectomieën worden in alle deelnemende ziekenhuizen verricht, op vijf ziekenhuizen na. Het aantal ingrepen varieert van 1 tot maximaal 33 ingrepen per registratiejaar.
De vierde groep, de overige thoracale ingrepen, maakt een groot onderdeel (36%) uit van de dagelijkse praktijk van de longchirurg. Het betreft een heterogene groep, waarbinnen de ingrepen worden onderverdeeld zoals in figuur 2 is weergegeven.
De meest frequente verrichtingen binnen deze groepen staan benoemd in tabel 1. Hierin neemt de chirurgische behandeling van een pneumothorax en de chirurgische behandeling van een infectie in de thorax (decorticatie of empyeem behandeling) een grote plaats in. Het biopteren van longafwijkingen, dan wel de pleura, voor het verkrijgen van een diagnose vormt een derde groep hoog volume ingrepen.
| n | |
| Bullectomie en pleurectomie | 288 |
| Pleura biopten | 186 |
| Empyeem zonder decorticatie | 161 |
| Thoraxwand nno | 141 |
| Biopteren longlaesie | 132 |
| Decorticatie | 130 |
| Pleura resectie evt pleurodese | 106 |
In figuur 3 is de verdeling zichtbaar van het aantal en soort ingrepen uitgevoerd door longchirurgen over verschillende klinieken. Er is duidelijk een ander verdelingspatroon zichtbaar dan bij de anatomische resecties. Summatief hebben 14 klinieken meer dan 100 thoraxgerelateerde ingrepen geregistreerd en 31 klinieken hebben in totaal meer dan 50 ingrepen geregistreerd. Naast de ziekenhuizen die zowel veel parenchymresecties bij een longcarcinoom als overige ingrepen doen, zijn er ook ziekenhuizen die naast de 20 parenchymresecties veel overige ingrepen doen.
De complicaties na thoracale ingrepen door longchirurgen, geregistreerd in de DLSA, staan in tabel 2. Het hoge percentage complicaties in de groep ‘luchtwegen’ hangt samen met de zwaarte van de ingreep. De zeven patiënten met complicaties (58.3%) hadden allemaal een operatie ondergaan waarbij een bronchusfistel werd gesloten. Dit is een complex probleem, waarbij het slagen van de operatie altijd onzeker is, maar waarbij de kwaliteit van leven van de patiënt flink kan verbeteren. Hetzelfde kan gezegd worden over het complicatiepercentage in de subgroep ‘Thorax en Long overige’. Deze zijn gerelateerd aan de behandeling van een intra-thoracale infectie waarbij het complicatiepercentage respectievelijk 14,6 en 10,7% is. Het is de vraag of je hier moet spreken van een complicatie aangezien bij een infectie in de thorax, zoals een empyeem, het chirurgische ingrijpen maar een onderdeel is van de behandeling. Nadat de thorax is schoongemaakt, decorticatie van de long heeft plaatsgevonden - zodat deze zich weer goed kan ontplooien - en drains zijn geplaatst, volgt er altijd een antibiotische behandeling en wordt er een spoelsysteem aangelegd. Het empyeem is echter vaak een hardnekkig probleem en niet zelden keert de infectie terug of zakt de long weer in. Er moet regelmatig opnieuw ingegrepen worden, operatief of percutaan, als onderdeel van de behandeling.
| n | % | Totaal | |
| Thoraxwand | 9 | 4.8 | 189 |
| Thorax | 48 | 14.6 | 329 |
| Pleura | 18 | 5.6 | 320 |
| Long overig | 68 | 10.7 | 635 |
| Luchtwegen | 7 | 53.8 | 13 |
| Diafragmachirurgie | 4 | 13.8 | 29 |
Conclusie
Een groot aantal longchirurgische ingrepen valt op dit moment niet binnen het normerings- c.q. certificeringstraject van de longchirurgen en de klinieken waarin zij werkzaam zijn (60%). Deze ingrepen beslaan echter wel een groot deel van het werk van de longchirurg. Bij een volledige verrichtingenregistratie, zoals in de DLSA over 2012, halen alle ziekenhuizen een minimaal aantal van 20 ingrepen en 31 klinieken doen meer dan 50 ingrepen. Bij verschuivingen van longchirurgische ingrepen, bijvoorbeeld ten gevolge van concentratie van oncologische zorg, is dit een belangrijk gegeven, omdat ook de andere longchirurgische ingrepen moeten worden uitgevoerd door ervaren longchirurgen. Dit betekent een extra groot beslag op de ziekenhuizen waar de zorg geconcentreerd wordt, waarbij niet uit het oog moet worden verloren dat ook in de omliggende ziekenhuizen soms longchirurgische expertise nodig is. Het aantal geregistreerde complicaties is sterk gerelateerd aan de primaire ingreep. Bij patiënten geopereerd wegens een intra-thoracale infectie (empyeem, decorticatie en bronchopleurale fistel) is het aantal geregistreerde complicaties het hoogst.

Dutch Lung Radiotherapy Audit (DLRA)
In februari 2013 is de Dutch Lung Radiotherapy Audit (DLRA) van start gegaan. De DLRA moet meer inzicht gaan geven in de kwaliteit van de radiotherapeutische zorg voor longkankerpatiënten in Nederland. Dit moet uiteindelijk leiden tot verbetering van de zorguitkomsten. Het streven is dat alle radiotherapeutische centra in Nederland aan de registratie meedoen.
Een groot deel van de curatief behandelde longkankerpatiënten krijgt radiotherapie. Nieuwe ontwikkelingen in de behandeling van longkanker zoals stereotactische bestraling, intensiteit- gemoduleerde radiotherapie en beeldgestuurde radiotherapie leidden tot waargenomen verschillen in toxiciteit en effectiviteit. De Nederlandse Vereniging voor Radiotherapie en Oncologie (NVRO) wil transparantie wat betreft kwaliteit en veiligheid van de radiotherapeutische zorg van longkankerpatiënten in Nederland. Een landelijke prospectieve uitkomstregistratieis het beste instrument om dit te bereiken.De kwaliteitscommissie van de NVRO kreeg in samenwerking met het Landelijk Platform voor Radiotherapie bij Longkanker (LPRL) een SKMS subsidie om een kwaliteitsprogramma op te zetten voor bestralingsbehandelingen bij longkankerpatiënten.
Een voorbeeld van een nieuwe ontwikkeling is beeldgestuurde radiotherapie met tussentijdse aanpassing van het bestralingsveld op geleide van de cone-beam CT beelden die tijdens de bestraling worden gemaakt. Bij een lang tijdsinterval tussen een plannings-CT, gemaakt bij de voorbereiding van een bestralingsbehandeling, en de start van de bestraling kan er bij grote longtumoren al groei optreden buiten het ingetekende doelgebied. Hier liggen mogelijkheden voor verbetering. De NVRO heeft inmiddels streefnormen opgesteld voor de maximale wacht- en doorstroomtijden vanaf verwijzing.
Voor de praktische uitwerking is aansluiting gezocht bij DICA. Er is in 2012 een uitvoerige set van kwaliteitsindicatoren opgesteld en een database gebouwd. Zo wordt bijvoorbeeld gekeken naar procesindicatoren zoals het percentage patiënten bij wie de bestralingsbehandeling binnen 21 dagen na verwijzing is gestart, maar ook naar ‘echte’ uitkomsten zoals het percentage patiënten dat binnen drie maanden na het einde van de bestraling is overleden. Tevens wordt de acute toxiciteit gescoord (CTC graad 3 en hoger). Er is een pilot-database getest in één radiotherapie centrum en momenteel is de pilot uitgebreid naar zeven centra in Amsterdam Maastricht, Nijmegen, Leeuwarden, Arnhem, Den Haag en Eindhoven. We verwachten, na het beëindigen van de pilotfase, een landelijke uitrol in oktober 2013.
Dit nationale initiatief om de behandelingsresultaten van longkankerpatiënten inzichtelijk te maken zal naar verwachting een verbetering van de zorg voor longkankerpatiënten geven en zal ook helpen om evidence-based richtlijnen snel landelijk te kunnen implementeren.

Dutch Surgical Aneurysm Audit (DSAA) en Dutch Audit for Carotid Interventions (DACI)
In 2013 start de Nederlandse Vereniging voor Vaatchirurgie onder auspiciën van DICA twee clinical audits. Op 1 januari 2013 is gestart met de Dutch Surgical Aneurysm Audit (DSAA) en op 1 juli 2013 zal gestart worden met de Dutch Audit for Carotid Interventions (DACI).
Zowel electieve operaties van het abdominale aneurysma van de aorta (AAA) als interventies aan de arteria carotis interna zijn profylactische operaties die gedaan worden om een ernstig beloop van de onderliggende ziekte te voorkomen. Electieve aneurysma operaties worden verricht om een ruptuur en daarmee samenhangend risico op overlijden te voorkomen. Interventies aan de arteria carotis verlagen het risico op een Cerebro- Vasculair- Accident (CVA) en daarmee samenhangende blijvende invaliditeit of overlijden. Voor beide patiëntengroepen geldt dat de bereikte resultaten sterk afhankelijk zijn van de perioperatieve complicaties. Beide ingrepen vallen in 2013 onder de basisset kwaliteitsindicatoren van de Inspectie voor Gezondheidszorg (IGZ). Voor operaties aan het abdominale aneurysma bestaat een volume-indicator van 20 electieve operaties per team per jaar en voor de carotis operaties zijn proces en uitkomstindicatoren gedefinieerd. Patiënten met een symptomatische carotis stenose moeten binnen drie weken na hun presentatie met een Temporary Ischemic Attack (TIA) of CVA geopereerd zijn. Waarbij tevens de postoperatieve CVA’s en de postoperatieve mortaliteit moeten worden gerapporteerd. Over de indicaties van zowel aneurysma als carotis operaties bestaat in de chirurgische literatuur en richtlijnen, zowel de internationale als de Nederlandse, duidelijke consensus.
Aneurysma aortae abdominalis
Het aneurysma van de aorta abdominalis is een lokale verwijding van de aorta, deze verwijding kan beginnen onder (infrarenaal), ter hoogte van (pararenaal) of boven (suprarenaal) de nierarteriën. De diagnose wordt meestal bij toeval gesteld na beeldvormende diagnostiek van de buik door middel van echografie, CT scanning of MRI. Lichamelijk onderzoek is niet voldoende betrouwbaar voor het aantonen of uitsluiten van de aanwezigheid van een aneurysma. De incidentie van het aneurysma is niet exact bekend, postmortem studies tonen een prevalentie van ongeveer 6%. In 2010 bedroeg het aantal ziekenhuis opnames voor het abdominaal aneurysma ruim 4900. De behandeling is afhankelijk van de diameter van het AAA en de comorbiditeit van de patiënt. Afhankelijk van de diameter van het aneurysma hebben patiënten een toenemende kans op een ruptuur. De kans op overlijden aan een geruptureerd aneurysma van de aorta wordt geschat op ongeveer 80%. Hoewel het exacte risico op een ruptuur bij een bepaalde diameter niet bekend is, bestaat er, volgens de huidige inzichten, een operatie indicatie bij een diameter van 5,5 cm, omdat vanaf deze diameter het geschatte 1-jaars ruptuurrisico exponentieel toeneemt. Bij de beslissing over wel of niet opereren speelt uiteraard de comorbiditeit van de patiënt een grote rol. Afhankelijk van de anatomie van het aneurysma kan gekozen worden voor een open reconstructie of een endovasculaire benadering (EVAR). Voor de audit zijn twee datasets gedefinieerd. Een basisset, die verplicht is, en een uitgebreidere dataset waaruit uitgebreidere wetenschappelijke vraagstukken moeten kunnen worden beantwoord. Voor casemix correcties is in beide datasets gekozen voor de v-Possum. V-Possum staat voor Vasculair Physiological and Operative Severity Score for enUmeration of Mortality and Morbidity. Een door Copeland ontwikkeld en later door Prytherch verbeterd scorings systeem waarbij twaalf fysiologische en zes operatieve parameters worden gebruikt voor de risico inschatting van de procedure.1 2 In een pilotfase zijn beide datasets ruim een jaar getest in het AMC en het LUMC. Op 1 januari 2013 is begonnen met de landelijke audit. De audit is goed van start gegaan en enkele weken na de start hebben zich al meer dan 50 klinieken aangemeld bij de DSAA.
Carotis operaties
In Nederland ontstaat jaarlijks bij ongeveer 45.000 mensen een beroerte. Bij een beroerte is in ongeveer 75% van de gevallen sprake van een herseninfarct. Bij 15% van de patiënten met een TIA en 10% van de patiënten met een herseninfarct in het stroomgebied van de arteria carotis interna wordt een vernauwing (stenose) van meer dan 50% gevonden. De kans op een (recidief) herseninfarct stijgt met de ernst van de stenose en is het grootst in de eerste dagen/weken na het event. Het NASCET-onderzoek en het ECST-onderzoek hebben onafhankelijk van elkaar aangetoond dat carotis endarteriëctomie (CEA) zinvol is bij patiënten met een ernstige symptomatische carotisstenose. 3,4Patiënten met een recente amaurosis fugax, een TIA of een niet invaliderend herseninfarct en een carotisstenose komen in aanmerking voor een operatie waarbij de vernauwing van het bloedvat wordt opgeheven, een carotis endarteriëctomie (CEA). In Nederland worden ruim 1700 carotis operaties per jaar verricht. Het doel van een CEA is het risico op een (invaliderend) CVA of dood te reduceren. Het voordeel van deze operatie ligt uiteraard in de balans tussen het natuurlijk beloop van de ziekte en het risico van de chirurgische behandeling. Een carotis endarterectomie is een hoog risico operatie met een risico van 4-7% op een postoperatief CVA of dood. Uit een meta-analyse blijkt dat de gepoolde absolute risicoreductie over een periode van vijf jaar voor het optreden van een herseninfarct 16% is. Het effect is het grootst als binnen twee weken na het initiële incident geopereerd wordt met een Number Needed to Treat (NNT) van 6, bij een operatie na drie maanden is de NNT 12. Rockman beschrijft in een retrospectieve analyse van carotis endarteriëctomieën na een TIA of beroerte dat het risico op een perioperatieve (binnen 30 dagen na de operatie) beroerte groter was in de groep die binnen vier weken werd geopereerd (5,1%) dan in de groep die na meer dan vier weken werd geopereerd (1,6%, p=0,002).5 De afweging moet dus zijn of het gunstige effect van vroeg opereren opweegt tegen het mogelijk verhoogde risico op complicaties. Opereren binnen twee weken, bij een operatierisico van 5%, zal per 1000 operaties ruim 200 beroertes voorkomen in vijf jaar.6
Voor de casemix correctie is net als bij de aneurysma audit gekozen voor de v-Possum score. Zoals eerder gezegd is het de verwachting dat binnen enkele weken gestart kan worden met de DACI.
Referenties
1.
Dutch Melanoma Treatment Registry (DMTR)
In 2013 gaat de Dutch Melanoma Treatment Registry van start. In deze DICA registratie worden gegevens van alle patiënten, gediagnosticeerd met een uitgezaaid melanoom (stadium IIIc en IV) verzameld. De aanleiding voor deze registratie is de recente introductie van nieuwe geneesmiddelen voor de behandeling van melanoom in Nederland. Deze middelen hebben een specifiek indicatiegebied en gaan gepaard met bijwerkingen, waarvoor speciale expertise, vroege herkenning en adequate behandeling noodzakelijk is. Bovendien zijn de middelen erg kostbaar, waarbij het doelmatig inzetten van deze middelen bijzondere aandacht behoeft. De Nederlandse Vereniging voor Medische Oncologie heeft daarom in overleg met het Ministerie van VWS besloten deze behandelingen te concentreren in speciaal daarvoor aangewezen melanoomcentra. Bovendien zal het gebruik, de effectiviteit en de doelmatigheid van de nieuwe melanoom middelen worden gemonitord met behulp van een Registry, die volgens de DICA-systematiek wordt opgezet.
Klinische registraties
Naast de registratie van klinische gegevens met het doel betekenisvolle kwaliteitsinformatie terug te koppelen aan zorgverleners (clinical auditing), zijn er ook andere redenen om informatie betreffende het zorgproces en de zorguitkomsten te verzamelen. DICA audits leveren bijvoorbeeld ook gegevens voor de kwaliteitsindicatoren van IGZ, Zichtbare Zorg en de darm- en borstkankermonitor van patiëntenverenigingen, zodat ziekenhuizen de door hen geleverde kwaliteit inzichtelijk kunnen maken (transparantie). Ook bij de introductie van nieuwe technieken of geneesmiddelen in de klinische praktijk is er behoefte de implementatie te monitoren. Zo is in de DSCA de invoering van laparoscopische colorectale resecties in Nederland gemonitord en het zelfde gebeurt in de longchirurgische audit (DLSA) met de VATS lobectomieen, om de veiligeintroductie van deze technieken in de Nederlandse gezondheidszorg te zekeren.
De introductie van nieuwe geneesmiddelen, die zich weliswaar hebben bewezen in de gecontroleerde setting van klinische trials, kan eveneens een reden zijn om het gebruik en het effect in de ‘normale populatie’ te monitoren. Dit geldt vooral als er sprake is van middelen met ernstige bijwerkingen of wanneer er een groot beroep wordt gedaan op de gezondheidsmiddelen (doelmatigheid).
Registries
Om inefficiëntie, wildgroei van registraties en onacceptabele registratielast te voorkomen, is het belangrijk om tot een bundeling van de verschillende registratievragen te komen. Een Registry, zoals door de DICA wordt opgezet voor de behandeling van het melanoom, voorziet daar in. Een Registry is een centrale database met klinische gegevens van patiënten, eventueel gekoppeld aan patiënt reported outcomes (PROMs), financiële informatie en/of een weefselbank van waaruit informatie gegenereerd kan worden voor verschillende doelen:
- Clinical auditing: voor zorgzwaarte gecorrigeerde spiegelinformatie voor zorgverleners die een continue verbetercyclus op gang brengt.
- Transparantie: eenduidig verzamelde en geanalyseerd kwaliteitsinformatie in de vorm van kwaliteitsindicatoren te gebruiken voor externe verantwoording en keuzeinformatie voor patiënten en zorgverzekeraars.
- Kwaliteitsonderzoek: het op populatieniveau onderzoeken van ‘bad’ en ‘best practices’, om knelpunten in de zorg te identificeren en te verbeteren, zoals dat door de wetenschappelijke commissies van de DICA registraties wordt gedaan.
- Doelmatigheidsonderzoek: de beoordeling van het effect van een (nieuwe) techniek of geneesmiddel in de alledaagse praktijk, inclusief de gezondheidswinst en de kosten die daarmee gepaard gaan.
- Wetenschappelijk onderzoek: onderzoeksvragen vanuit wetenschappelijk perspectief aanvullend op de gegevens uit klinische trials, gericht op specifieke patiëntengroepen, zoals ouderen, die vaak ondervertegenwoordigd zijn in deze trials.
- Tissue banking: voor de interpretatie van (tumor)gegevens verzameld in een weefselbank is het essentieel dat deze gekoppeld zijn aan de klinische gegevens betreffende patiëntenkarakteristieken (leeftijd, geslacht, comorbiditeit), de diagnose (stadium van de ziekte) en voorafgaande behandelingen en hun bijwerkingen.
In een DICA registry staat de patiënt centraal en is er sprake van een patiëntvolgsysteem, vanaf het moment van inclusie, met zowel retro- als prospectief verzamelde informatie over de behandelingen die de patiënt ondergaat en de effecten daarvan. ProMISe, het software systeem dat DICA gebruikt, is hier voor uitermate geschikt en bij de beheerder van het systeem is er veel ervaring, onder meer in de vorm van de al jarenlang ondersteunde Europese beenmergtransplantatie registratie. Bovendien is aan alle randvoorwaarden, zoals de Privacy wetgeving, voldaan en is er een patiëntenportal ontwikkeld via welke pati-nttevredenheids gegevens (PREMs) en PROMs verzameld kunnen worden.
Melanoom behandelingen
De prognose van patiënten met een gemetastaseerd melanoom (stadium IIIc en IV) is doorgaans slecht, met een mediane overleving van een half jaar. Tot voor kort waren de systemische behandelingsmogelijkheden zeer beperkt en weinig kansrijk. Hier is in de afgelopen twee jaar verandering in gekomen met de introductie van de anti-CTLA-4 monoclonale antilichamen (Ipilimumab) en BRAF-kinase remmers (Vemurafenib, Dabrafenib). Beide type middelen hebben hun eigen indicatiegebied en specifiek toxiciteitsprofiel, waarvoor ervaring met de behandeling van patiënten met een gemetastaseerd melanoom en het gebruik van deze middelen van belang is voor kwalitatief goede zorg.
Kwaliteitsnormen
In dit kader hebben de Samenwerkende Oncologische Specialismen (SONCOS), een samenwerkingsverband van de Nederlandse Vereniging voor Radiotherapie en Oncologie (NVRO), de Nederlandse Vereniging voor Chirurgische Oncologie (NVCO) en de Nederlandse Vereniging voor Medische Oncologie (NVMO) multidisciplinaire kwaliteitsnormen opgesteld voor de behandeling van melanoom. Bovendien is afgesproken dat stadium IIIc en IV melanoom alleen nog wordt behandeld in de daartoe aangewezen centra, met een voldoende volume en ervaring met de behandeling van deze patiënten. De Nederlandse Zorgautoriteit (NZA) heeft op voordracht van de NVMO hiertoe veertien melanoomcentra, verspreid over het land, aangewezen. De melanoomcentra zijn gehouden een register bij te houden van alle patiënten met stadium IIIc en IV melanoom, die naar hen worden verwezen of met hen worden overlegd.
Melanoma Registry
De doelstellingen van dit register, de Dutch Melanoma Treatment Registry (DMTR), zijn de volgende:
- Verschaffen van spiegelinformatie aan de behandelaars teneinde de zorg voor melanoom patiënten continu te verbeteren (clinical audit)
- Het monitoren van de introductie van de nieuwe melanoommiddelen in de dagelijkse klinische praktijk
- Het identificeren van patiëntengroepen waarin de behandeling het meest effectief kan worden ingezet
- Verzamelen van gegevens voor doelmatigheidsonderzoek (T=4) voor de middelen Ipilimumab, Vemurafenib en in een later stadium Dabrafenib en andere te introduceren middelen voor deze patiëntengroep
- Transparantie van kwaliteit van zorg richting zorgverleners, patiënten, zorgverzekeraars en overheid.
Om deze doelen te bereiken is besloten tot het opzetten van een populatie-gebaseerd register, waarin gestreefd wordt naar 100 procent dekking van patiënten die in Nederland gediagnosticeerd worden met stadium IIIc en IV melanoom. Bovendien zal het een continu register zijn dat een platform vormt voor continue kwaliteitsverbetering, transparantie, wetenschappelijk onderzoek, inclusief doelmatigheidsonderzoek. Bij de introductie van nieuwe geneesmiddelen voor deze patiëntengroep moet de DMTR database gebruikt kunnen worden om ook deze middelen te evalueren.
Samenwerking
De Nederlandse Vereniging voor Medische Oncologie (NVMO) heeft het Dutch Institute for Clinical Auditing (DICA) gevraagd haar te ondersteunen bij het opzetten van de Dutch Melanoma Treatment Registry (DMTR). Gezien de inhoudsdeskundigheid zijn de beroepsorganisaties daar uitdrukkelijk bij ‘in the lead’. DICA faciliteert en zorgt er voor dat alle randvoorwaarden geregeld zijn en de continuïteit geborgd. De DMTR is bovendien opgesteld en afgestemd met alle belanghebbenden van het register. Het betreft de volgende organisaties:
- Stichting Samenwerkende Oncologische Specialismen (NVMO, NVCO, NVRO)
- Nederlandse Vereniging voor Pathologie (NVvP)
- Werkgroep Immunotherapie Nederland voor Oncologie (WIN-O)
- Stichting Melanoom
- ZON-MW programma Goed Geneesmiddelen Gebruik
- Ministerie van VWS
- College voor Zorgverzekeringen (CVZ)
- Zorgverzekeraars (Achmea)
- Bristol-Myers Squibb (BMS)
- Roche
- Glaxo Smith Kline (GSK)
Door de vraag naar informatie van deze partijen te bundelen wordt voorkomen dat partijen afzonderlijk registraties opzetten met het risico op ‘doublures’, onevenredige registratielast en verspilling van gelden binnen de gezondheidszorg. Met deze unieke samenwerking kan bovendien een blauwdruk neergezet worden voor geneesmiddelen Registries, zowel binnen als buiten de oncologie.
Organisatie en rapportage
In de uitvoering van de DMTR is DICA de centrale onafhankelijke organisatie die zorgt dat de gegevens verzameld, beheerd, geanalyseerd en teruggekoppeld worden aan de verschillende partijen. Zo heeft DICA veel ervaring met een beveiligd systeem voor webbased gegevensinvoer, databeheer en –analyse en een snelle webbased terugkoppeling aan de zorgverleners, die zal plaatsvinden via een mijnMelanoom website voor ieder melanoomcentrum. Ook de betrokken Pharma partijen krijgen een terugkoppeling van het gebruik van hun geneesmiddel in de populatie. Bovendien hebben de Pharma partijen behoefte aan zogenoemd T=4 onderzoek, voor het herbeoordelingsdossier voor CVZ van hun geneesmiddel, circa 4 jaar na de introductie op de Nederlandse markt. Als laatste zorgt de DICA voor transparantie van de geleverde zorg, door jaarlijks de deelregistraties de mogelijkheid te geven hun resultaten te rapporteren op het DICA congres. Bovendien is er een jaarlijks overleg met de betrokken beroepsverenigingen, zorgverzekeraars en patiëntenverenigingen waarin afspraken worden gemaakt over indicatoren die uit de registratie aangeleverd kunnen worden.
Partners
DICA werkt bij het opzetten van de DMTR met een aantal partners. Ten eerste heeft SONCOS het Integraal Kankercentrum Nederland (IKNL) gevraagd zorg te dragen voor de invoer van gegevens in de DMTR. De melanoomcentra kunnen het IKNL vragen de gehele dataregistratie voor hen uit te voeren, ook is het mogelijk met eigen datamanagers te werken. In beide gevallen zullen de datamanagers een uniforme instructie krijgen en zal er dataverificatie plaatsvinden om de betrouwbaarheid van de ingevoerde gegevens te waarborgen. Ook wordt er een ‘standard operating procedure’ ontwikkeld om er zorg voor te dragen dat alle patiënten die aan de inclusiecriteria van de Registry voldoen, ook aangemeld worden voor registratie. Het IKNL zal periodiek onderzoek doen naar de volledigheid van de DMTR zoals dat ook voor de andere clinical audits van de DICA gebeurt.
Ten tweede werkt DICA voor het doelmatigheidsonderzoek samen met het Instituut voor Medical Technology Assessment (iMTA) van de Erasmus Universiteit. Dit instituut heeft veel ervaring met het uitvoeren van doelmatigheidsonderzoek voor geneesmiddelen binnen de oncologie en zal bovendien voor extra dataverzameling zorgen in een beperkt aantal ziekenhuizen om de kosten waarmee de melanoombehandelingen gepaard gaan volledig in beeld te krijgen.
Governance
De DMTR heeft een bestuur, waarin gemandateerde leden van de betrokken beroepsverenigingen (SONCOS, NVMO, NVCO, NVvP) zitting hebben, aangevuld met leden van het bestuur van de WIN-O en de patiëntenvereniging. De bestuursleden zijn ook lid van een bredere wetenschappelijk commissie, waar verder een vertegenwoordiger van elk melanoomcentrum lid van is, even als epidemiologen, onderzoekers en experts op het gebied van de ‘medical technology assessment’. Alle andere betrokken partijen, zoals de pharma-partijen, de ziekenhuizen, ZonMW, VWS et cetera zijn vertegenwoordigd in een Raad van Advies voor de DMTR. De methodologische kwaliteit en onafhankelijkheid van de analyses zal bovendien bewaakt worden door de Methodologische Raad van de DICA, waar statistici, besliskundigen, epidemiologen, MTA-experts en een vertegenwoordiger van de Inspectie voor de Gezondheidszorg zitting in hebben.
Blauwdruk
Met de hulp van VWS en ZonMW zetten de beroepsverenigingen samen met DICA nu de volgende stap in het bevorderen van de kwaliteit en doelmatigheid van de zorg. DMTR wordt neergezet als een blauwdruk voor toekomstige Registries, binnen en buiten het oncologische domein. De beroepsverenigingen en multidisciplinaire onderzoeksgroepen zijn hier bij ‘in the lead’. DICA verbindt de wensen van alle betrokken partijen, faciliteert samen met haar partners de gebruikers en zorgt voor de professionaliteit, eenduidigheid en continuïteit die essentieel is voor het opzetten van waardevolle Registries.

Dutch Pancreatic Cancer Audit (DPCA)
Medio 2013 gaat de Dutch Pancreatic Cancer Audit (DPCA) van start. De DPCA wordt uitgevoerd door de multidisciplinaire tumorwerkgroep Dutch Pancreatic Cancer Group (DPCG) in samenwerking met de Dutch Institute for Clinical Auditing (DICA) en Medical Research Data Management (MRDM). Omdat de DPCG clinical auditing wil integreren in een meer gedetailleerde wetenschappelijke database voor patiënten met pancreas- en periampullaire tumoren zal zij, via MRDM, de ingevoerde data zelf beheren. Hierdoor kunnen de geregistreerde data naast de audit direct beschikbaar komen voor wetenschappelijke onderzoeksdoeleinden binnen de DPCG en tevens gebruikt worden voor koppeling van klinische gegevens aan de in de PancreasParel verzamelde tumorweefsels. In aanvulling op deze dataregistraties is de DPCG voornemens ook Patient-Reported Outcome Measures (PROMs) te verzamelen, waardoor inzicht kan worden verkregen in de kwaliteit van leven van de patiënten in deze populatie en hun perceptie van de kwaliteit van geleverde zorg. Hiertoe werkt de DPCG samen met twee patiëntenorganisaties, de Alvleeskliervereniging en de Stichting voor Patiënten met Kanker aan het Spijsverteringskanaal (SPKS). Naast de klinische specialisten zoals chirurgen, medisch oncologen, MDL-artsen en radiotherapeuten zijn ook de radiologen en pathologen nauw betrokken bij deze audit en dataregistratie. Het is de bedoeling dat vanaf medio 2014 ook gegevens van patiënten met niet resectabele, danwel uitgezaaide pancreas- en periampullaire tumoren geregistreerd zullen gaan worden.
Pancreascarcinoom
Jaarlijkse wordt bij ongeveer 3000 mensen een pancreastumor of een periampullaire tumor gediagnosticeerd. Zowel de audit als de landelijke richtlijn combineert patiënten met pancreas- en periampullaire tumoren, omdat beide groepen mogelijk in aanmerking komen voor een pancreasresectie. Ruim 2000 van deze patiënten hebben pancreaskanker. Pancreaskanker is de vijfde meest voorkomende oorzaak van kanker gerelateerd overlijden, na long-, borst-, prostaat- en darmkanker in Nederland, volgens de European Cancer Observatory1. Resectie van pancreaskanker is de enige kans op lange termijn overleving, maar is slechts mogelijk bij 15 tot 20 procent van de patiënten.
Pancreaschirurgie
Pancreaschirurgie is hoog-complexe chirurgie, waarbij de variatie in uitkomsten van zorg tussen ziekenhuizen groot is, zeker als dit vergeleken wordt met andere tumoren. Door concentratie van deze chirurgie in centra met voldoende volume (NVvH/IGZ norm van >20 Whipple resecties per jaar) is de ziekenhuismortaliteit in Nederland gedaald van 9,8% naar 5,1% (zie figuur 1) maar verdere verbetering blijft nodig2. Omdat pancreaskanker veel voorkomt en de ziekenhuismortaliteit ook in hoogvolume centra nog steeds rond de 5% is en de impact van morbiditeit hoog is, blijft er ruimte voor verbetering. Alleen concentratie van zorg in enkele centra is hiervoor niet voldoende3.
Kwaliteit verbeteren
De kwaliteit van de zorg voor patiënten met pancreaskanker is in Nederland van hoog niveau. Het doel van deze audit is om deze kwaliteit nog verder te verbeteren, onder andere door verschillen tussen behandelaars in kaart te brengen. Deze audit kan vaststellen welke verschillen in besluitvorming, het zorgproces en de chirurgische techniek verantwoordelijk zijn voor verschillen in uitkomst van zorg. Middels een verbetertraject kunnen vervolgens de besluitvorming, het zorgproces en de chirurgische techniek worden geoptimaliseerd hetgeen niet alleen tot een betere kwaliteit leidt maar ook de kosten van de zorg beheersbaar houdt of zelfs reduceert.
Kwaliteitsindicatoren
Aanvankelijk is de focus van de pancreas audit gericht op patiënten die in aanmerking komen voor chirurgische behandeling. Met een systematisch literatuur onderzoek zijn de belangrijkste kwaliteitsindicatoren voor de zorg voor patiënten met zowel premaligne als maligne pancreas- en periampullaire tumoren vastgesteld. Kwaliteit kan gemeten worden met procesindicatoren en patiëntuitkomsten. De periode tussen multidisciplinaire bespreking van een patiënt en de operatie is bijvoorbeeld zo´n procesindicator. Voor procesindicatoren is er een selectie gemaakt uit de 72 aanbevelingen in de nationale richtlijn voor pancreaskanker4. Daarnaast zijn de belangrijkste uitkomsten van zorg geselecteerd uit een lijst van 112 patiëntuitkomsten die een literatuuronderzoek aangedragen heeft. Ten eerste gaat het hierbij om mortaliteit en complicaties van de chirurgische behandeling, zoals bijvoorbeeld pancreasfisteling (lekkage van de nieuwe verbinding tussen pancreas en darm) en vertraagde maagontlediging. De laatste jaren heeft de International Study Group voor Pancreatic Surgery (ISGPS) de belangrijkste chirurgische complicaties van duidelijke definities voorzien, hetgeen deze uitermate geschikt maakt voor onderlinge vergelijking tussen verschillende klinieken. Om de ernst van een complicatie vast te stellen, wordt gebruik gemaakt van de Clavien-Dindo classificatie die internationaal veel wordt toegepast. De DPCG heeft ervoor gekozen alleen belangrijke complicaties (Clavien-Dindo graad 3) of hoger te registreren, om de registratielast en de kosten hiervan te beperken. Ten tweede worden ook de langetermijnuitkomsten van deze oncologische zorg geregistreerd zoals overleving (zowel ziektevrije als totale overleving). Gekoppeld aan de verzameling van biomateriaal (serum en tumorweefsel) binnen het PancreasParel project kan met deze klinische parameters in de toekomst informatie gebruikt worden om op het individu toegespitste zorg te bieden (´personalized cancer care´).
Kwaliteitsvergelijkingen
Vergelijking van uitkomsten van zorg tussen behandelaars is alleen mogelijk als patiëntengroepen vergeleken worden die daadwerkelijk vergelijkbaar zijn. Het is derhalve van groot belang de casemix goed in beeld te brengen alvorens een goede vergelijking tussen klinieken te kunnen maken. Patiënten met pancreaskanker verschillen wat betreft het stadium van de ziekte en hun algehele gezondheid. In een literatuuronderzoek stelden wij 107 factoren vast waarin patiënten met pancreaskanker van elkaar kunnen verschillen. Hieruit is een selectie gemaakt van die factoren die een op basis van literatuur bewezen invloed hebben op complicaties van de chirurgische behandeling of op de (ziektevrije of totale) overleving. In deze audit worden naast kwaliteitsindicatoren ook deze (casemix)factoren geregistreerd, opdat uiteindelijk uitkomsten van vergelijkbare patiënten onderling worden vergeleken en mogelijke verschillen in populaties per instituut inzichtelijk worden.
Besluitvorming
Tenslotte zullen ook die patiënten geregistreerd worden die na een multidisciplinaire beoordeling niet in aanmerking komen voor chirurgische behandeling. Het gaat hierbij voornamelijk om patiënten die weliswaar geen uitzaaiingen hebben, maar voor wie besloten is dat het niet zinvol is om de tumor te verwijderen door betrokkenheid van essentiële bloedvaten, met de verwachting dat een operatie niet tot een langere overleving zal leiden. De besluitvorming of een patiënt baat heeft bij chirurgische behandeling is complex en kan door dit aspect van de audit beter in kaart worden gebracht. Ook kunnen verschillen tussen ziekenhuizen in criteria gebruikt in dit besluitvormingsproces inzichtelijk gemaakt worden.
Multidisciplinaire audit
Aangezien de diagnostiek en behandeling van pancreaskanker multidisciplinair is en slechts ongeveer 20% van de gediagnostiseerde tumoren aan chirurgische interventie toe komt, is het van groot belang dat ook andere medisch specialisten, zoals medisch oncologen en MDL-artsen de uitkomsten van zorg bij deze patiënten inzichtelijk maken middels auditing. Binnen de DPCG bestaat dan ook grote interesse van deze specialismen om de auditing met hun expertise uit te breiden zodat een multidisciplinaire audit voor pancreaskanker in de nabije toekomst in het verschiet ligt.

European Pediatric Surgery Audit (EPSA)
De kinderchirurgische audit heeft met de oprichting van de European Pediatric Surgical Audit (EPSA) in 2012 vorm gekregen. EPSA is een stichting, geïnitieerd en opgericht door de Nederlandse Vereniging voor Kinderchirurgie (NVKC). EPSA heeft als doel door de registratie en analyse de kwaliteit van zorg voor kinderen met deze chirurgische aandoeningen te bewaken en te verbeteren. Gekozen is voor registratie en auditing van zes chirurgische aandoeningen, die relatief frequent bij pasgeborenen voorkomen, in samenwerking met het Dutch Institute of Clinical Auditing (DICA).
Kinderchirurgie en chirurgie bij kinderen
Chirurgie bij kinderen en kinderchirurgie is een verzamelnaam voor chirurgie bij kinderen jonger dan 18 jaar. Een deel van deze chirurgie wordt (speciële) kinderchirurgie genoemd. Dit betreft operaties bij kinderen jonger dan 1 maand of kinderen die prematuur geboren zijn en operaties bij kinderen die qua grootte of complexiteit in een kinderchirurgisch centrum behoren te worden gedaan zoals operaties bij aangeboren afwijkingen, oncologische ingrepen en transplantaties. Speciële kinderchirurgie wordt conform adviezen van de Gezondheidsraad en een besluit van de Nederlandse Verenging voor Heelkunde (NVvH) in zes Nederlandse centra gedaan om de kwaliteit van zorg voor deze groep kinderen zo veel mogelijk te garanderen. De NVKC heeft als doelstelling de kwaliteit van zorg voor zowel chirurgie bij kinderen als speciële kinderchirurgie te bewaken en te verbeterenen heeft een stichting opgericht om deze doelstellingen te helpen realiseren.
Kwaliteitsbeleid
De NVvH en de NVKC hebben, in samenspraak met de Nederlandse Vereniging voor Kindergeneeskunde en de Nederlandse Vereniging van Anesthesiologie, normen vastgesteld waaraan ziekenhuizen waar chirurgie bij kinderen wordt verricht, moeten voldoen. Voorts zijn er normen opgesteld waaraan chirurgen die operaties uitvoeren bij kinderen moeten voldoen. Chirurgen die kinderen opereren, kunnen retrograad worden gecertificeerd als ze aan bepaalde voorwaarden voldoen. Ook is vastgelegd aan welke competenties nieuw opgeleide chirurgen moet voldoen voor antegrade certificering als chirurg bij kinderen.
Kwaliteitsregistratie
Een tiental jaar geleden is de NVKC begonnen met consensusbesprekingen en checklists van de behandeling van zes chirurgische aandoeningen bij pasgeborenen om de behandeling zo goed mogelijk te kunnen vergelijken en risicofactoren die de uitkomst beïnvloeden te kunnen identificeren. Gekozen is voor relatief frequent voorkomende aandoeningen met een aanzienlijke mortaliteit en belangrijke morbiditeit zodat door registratie de grootste kwaliteitswinst kan worden behaald. De relevantie van registratie wordt vergroot door de gemiddelde levensverwachting van deze groep kinderen die bij goede behandeling meestal normaal is. Derhalve kan met de registratie van enkele honderden kinderen per jaar een grote winst in ‘quality-adjusted life years’, QALYs, worden bereikt.
Om een goede audit te kunnen ontwikkelen, zijn met behulp van experts kwaliteitsindicatoren benoemd (tabel 1). Deze bestaan uit diverse proces- en uitkomstindicatoren omdat met structuurindicatoren (gezien het geringe verschil tussen de kinderchirurgische centra) relatief weinig kwaliteitswinst kan worden behaald. Via de EPSA-registratie worden periodiek de kwaliteitsindicatoren vergeleken om de zorg te optimaliseren. Hierbij wordt niet alleen de kwaliteit van zorg bewaakt, maar deze wordt ook verbeterd door analyse en toepassing van de bevindingen van de geregistreerde gegevens.
| 1 | Het percentage pasgeborenen met congenitale hernia diafragmatica dat in het eerste levensjaar overlijdt |
| 2 | Het percentage pasgeborenen met respiratoire insufficiëntie op basis van congenitale hernia diafragmatica dat overlijdt zonder ECMO behandeling. |
| 3 | Het percentage kinderen met een congenitale hernia diafragmatica dat is gescreend in de eerste twee levensjaren op cerebrale beschadiging en/of handicap. |
| 4 | Het percentage kinderen met congenitale anusatresie dat protocollaire screening heeft ondergaan |
| 5 | Het percentage kinderen met een wondinfectie of wondehiscentie na chirurgische correctie van de anusatresie. |
| 6 | Het percentage kinderen met fecale continentie op de leeftijd van 5 jaar na de chirurgische correctie van de anusatresie. |
| 7 | Het percentage kinderen met een klinische naadlekkage na chirurgische correctie van een slokdarmatresie met distale fistel. |
| 8 | Het percentage kinderen met een naadstenose na chirurgische correctie van een slokdarmatresie met distale fistel. |
| 9 | Het percentage kinderen met slokdarmatresie dat echografie van de nieren heeft gekregen. |
| 10 | Het percentage van kinderen met de Ziekte van Hirschsprung dat een ‘one stage’ operatie heeft gekregen. |
| 11 | Het aantal reoperaties binnen twee jaar na resectie van het aganglionaire darmsegment bij kinderen met de Ziekte van Hirschsprung |
| 12 | Het percentage kinderen met postoperatieve enterocolitis in de eerste twee jaar na resectie van darmsegment bij de Ziekte van Hirschsprung. |
| 13 | Het percentage kinderen van 5 jaar met defecatie problemen na resectie van darmsegment bij de Ziekte van Hirschsprung. |
| 14 | Het percentage kinderen met galgangatresie dat binnen acht weken een operatie heeft ondergaan. |
| 15 | Het percentage kinderen met galgangatresie waarbij het bilirubinegehalte binnen 6 maanden na operatie normaliseert. |
| 16 | Het percentage kinderen met galgangatresie dat op de leeftijd van een jaar protocollaire screening heeft ondergaan. |
| 17 | Het percentage kinderen met galgangatresie en een natieve lever dat overlijdt zonder levertransplantie. |
| 18 | Duur tot volledig enterale voeding bij kinderen met gastroschizis |
| 19 | Het percentage kinderen met gastroschizis dat in het eerste levensjaar overlijdt |
| 20 | Het percentage kinderen met gastroschizis dat een lijnsepsis ontwikkelt. |
| 21 | Het gemiddelde aantal ongeplande reoperaties binnen een jaar bij kinderen met omfalokèle waarvoor sluiting. |
| 22 | Het percentage kinderen met omfalokèle waarbij de klinische genetica binnen 3 maanden is geconsulteerd |
| 23 | Totale ziekenhuisopnameduur na de eerste vijf levensjaren van kinderen met omfalokèle |
Samenwerking
De behandeling van zowel kinderen met relatief eenvoudige chirurgische pathologie als van kinderen met ingewikkelde aandoeningen is niet alleen afhankelijk van de chirurg. Goede kindergeneeskundige zorg met goede kinderradiologie, pathologie en kinderanesthesiologie, is essentieel voor de beste zorg. Bij het benoemen van de kwaliteitsindicatoren is hiermee rekening gehouden. Zo weerspiegelt het aantal lijninfecties bij gastroschizis niet alleen de operatie, maar wordt de uitkomst voor in belangrijke mate beïnvloed door verpleegkundige zorg en de beslissingen van een neonatoloog. Een ander voorbeeld is de leeftijd waarop galgangatresie bij kinderen wordt gediagnosticeerd, een belangrijke parameter voor de lange termijn uitkomst en de noodzaak voor levertransplantatie. Deze diagnose is in grote mate afhankelijk van de competenties van kindergastroenteroloog, kinderradioloog en kinderpatholoog die deel uit maken van gestructureerd onderling overleg.
Patiëntenverenigingen spelen een steeds belangrijker rol bij de zorg voor patiënten. De NVKC werkt nauw samen met verschillende patiënten- en ouderverenigingen waarbij wederzijdse initiatieven om de zorg te verbeteren, worden omarmd en door elkaar worden ondersteund.
Europese samenwerking
Er is weinig tot geen ‘high level evidence’ voor de beste behandeling van kinderchirurgische aandoeningen. De meeste behandelingen zijn gebaseerd op retrospectieve analyses van kleine groepen kinderen of op ‘expert opinion’. In Nederland zijn de protocollen voor de behandeling van kinderen met complexe chirurgische aandoeningen in het algemeen niet erg verschillend. In andere Europese landen bestaan hier echter vaak andere ideeën over. Een vergelijking van behandelmethoden in diverse Europese landen is daarom wenselijk. Dit is mogelijk door een Europese registratie. Verder kan door een Europese registratie een betere benchmark worden verkregen voor de eisen waaraan goede zorg moet voldoen, waarbij voor Nederland een vergelijking met de beste Europese landen op zijn plaats is. Over uitrol van de kinderchirurgische audit wordt met Europese kinderchirurgische organisaties gesproken; die staan positief tegenover een Europese audit. Voor een Nederlandse patiënt houdt dit in dat er een betrouwbare benchmark voor kwalitatief goede zorg is met de mogelijkheid deze zorg te verbeteren. Hierdoor kunnen waarschijnlijk ook de kosten van de zorg worden gereduceerd. Om de wens tot Europese samenwerking te benadrukken is de ‘E’ van European toegevoegd Pediatric Surgical Audit en wordt vooralsnog de afkorting EPSA gebruikt.

Synopsis methodologie
Datacollectie
DSCA, DUCA, NBCA en DLSA maken gebruik van een beveiligd webbased registratiesysteem. Medewerkers van de deelnemende ziekenhuizen registreren de gevraagde items online. Enkele ziekenhuizen houden een eigen database bij en leveren deze dataset in zijn geheel elektronisch aan.
De medisch specialisten zijn verantwoordelijk voor de juistheid van de gegevens.
Onrealistische en conflicterende waarden
De dataset is gecontroleerd op onrealistische of paradoxale gegevens. Gedurende het registratiejaar zijn deze in de ‘kwaliteitsrapportage’ op mijnDICA (www.clinicalaudit.nl) teruggekoppeld aan de ziekenhuizen. Een voorbeeld is een lichaamslengte van 270 cm. Onrealistische waarden als deze zijn niet meegenomen in de analyses.
In het geval van conflicterende gegevens tussen een “hoofdvraag” en een “subvraag” is het antwoord op de hoofdvraag als juist beschouwd en is de subvraag niet meegenomen in de analyses.
Een voorbeeld is de hoofdvraag “Heeft de patiënt neo-adjuvante behandeling ondergaan?” Indien hier ‘nee’ is ingevuld, en er vervolgens wel is ingevuld dat neo-adjuvante behandeling chemoradiotherapie betrof, is dit laatste niet meegenomen in de analyses.
Overlap en verschil
In dit jaarrapport worden sommige resultaten in meerdere hoofdstukken en ook in voorgaande jaarrapporten genoemd. Het kan zijn dat deze resultaten in verschillende hoofdstukken andere uitkomsten hebben. Hier zijn een aantal redenen voor. Vaak is er sprake van een analyse van een andere selectie van patiënten (bijvoorbeeld alleen de patiënten die een in-opzet curatieve behandeling ondergingen).
Ook kan het zijn dat gegevens over voorgaande jaren, die gepresenteerd worden in dit jaarrapport, afwijken van de cijfers die in de eerdere jaarrapporten staan. Dit heeft te maken met het feit dat er ook in 2012 nog gegevens van patiënten die in 2011 zijn geopereerd zijn geregistreerd.
Analyseerbare patiënten
Voor inclusie van een patiënt in nadere analyses geldt een minimaal vereiste invoer van gegevens. Per deelregistratie is in het eerste hoofdstuk benoemd welke gegevens dit zijn en hoeveel patiënten niet konden worden meegenomen in nadere analyses.
Onbekende gegevens
Soms zijn bij een patiënt niet alle items volledig ingevuld. Het kan daarom zijn dat wanneer naar specifieke items gekeken wordt, de aantallen niet altijd optellen tot het totaal van de patiëntenpopulatie. Voor de percentages is dit wel het geval. Indien bij meer dan 5% van de patiënten een item ontbreekt, is apart weergegeven hoeveel missende gegevens er precies zijn. Hiervoor is gekozen om de tabellen overzichtelijk te kunnen houden. Soms is om bepaalde redenen anders besloten. Dit wordt dan apart vermeld.
Bij continue variabelen, zoals leeftijd en Body Mass Index, zijn percentages en/of gemiddelden berekend van alleen de patiënten met bekende en realistische gegevens.
Indien de vraag beslaat of een bepaalde procedure heeft plaatsgevonden, wordt bij patiënten bij wie het item niet is ingevuld, dit beschouwd als “nee” of “niet”. Een voorbeeld is een preoperatieve CT-thorax of postoperatieve complicaties. In enkele gevallen is besloten om de patiënten met ontbrekende gegevens uit te sluiten van analyse. Dit wordt dan als zodanig vermeld.
Statistische methoden
Een groot gedeelte van de gegevens zijn beschrijvend weergegeven. De DICA gebruikt veelal standaard statistische toetsen, zoals multivariate regressieanalyses, Chi-kwadraat toets (categorische variabelen) en de students’ t-test (continue variabelen) naar indicatie. De methodologische correctheid staat bij de DICA onder verantwoording van diverse statistici en epidemiologen die zitting hebben in de methodologische raad. Alle statistische analyses werden verricht met SPSS versie 20.
Casemixcorrectie
Om casemix-gecorrigeerde vergelijkingen tussen ziekenhuizen te kunnen doen, zijn een groot aantal patiënt- en ziektegebonden factoren uitgevraagd zoals leeftijd, geslacht, lengte, gewicht, comorbiditeit en tumorstadium.
Met een univariate analyse is per casemixfactor geanalyseerd of deze van invloed op de uitkomst (bijvoorbeeld mortaliteit, gecompliceerd beloop, borstsparende operaties) was. Casemixfactoren met een significantie-niveau van p<0,1 zijn vervolgens geïncludeerd in een model voor een backward stepwise multivariate regressie-analyse. Hierin wordt de invloed van casemixfactoren op de uitkomst bepaald, waarbij gecorrigeerd wordt voor onderlinge afhankelijkheid. Een significantie van p=0,05 of kleiner is in dit model aangehouden als bijdragend aan het correctiemodel.
De uiteindelijke gecorrigeerde percentages van uitkomsten zijn tot stand gekomen door het ware (‘geobserveerd’) percentage van een uitkomst van een ziekenhuis te delen door het (door het multivariate regressiemodel berekende) percentage wat je verwacht aan de hand van de casemixfactoren (‘verwacht’). In de funnelplots wordt deze ratio vermenigvuldigd met het ware gemiddelde van de gehele populatie. Zo worden de verschillen tussen ziekenhuizen weergegeven.
Funnelplots
Funnelplots zijn gebruikt voor grafische weergave van casemix gecorrigeerde verschillen tussen ziekenhuizen voor bepaalde uitkomsten (zie figuur 1). Iedere stip stelt een ziekenhuis voor. In de regel staat het ziekenhuisvolume op de X-as en de betreffende uitkomst op de Y-as. In de funnelplots zijn ziekenhuizen, waarvan meer dan 15% van de ingevoerde patiënten geen correctie kon worden berekend in verband met ontbrekende casemixfactoren, soms (ter illustratie) apart weergeven omdat hun correctie minder betrouwbaar kon plaatsvinden .
Het gemiddelde is weergegeven als een onderbroken streep, midden tussen de kromme lijnen.
De kromme lijnen geven de betrouwaarheidsintervallen weer en zijn afhankelijk van de hoeveelheid patiënten in de analyse en van de gemiddelde uitkomst.
De binnenste (grijze) lijnen zijn de 95% betrouwbaarheidsintervallen. Bij gemiddelde prestaties van ieder ziekenhuis is te verwachten dat 5% van de ziekenhuizen buiten deze lijnen valt.
De buitenste, rode lijnen zijn de 99,8% betrouwbaarheidsintervallen. Bij gemiddelde prestaties van ieder ziekenhuis is te verwachten dat 0,2% van de ziekenhuizen buiten deze lijnen valt. Bij ongeveer 100 ziekenhuizen in de analyses is dus met grote zekerheid te zeggen dat de ziekenhuizen die buiten de 99,8% betrouwbaarheidsintervallen vallen, significant meer of minder scoren dan gemiddeld.
Verklarende woordenlijst
| Abces | Ingekapselde hoeveelheid pus in een niet eerder bestaande holte in het lichaam |
| Abdominale sepsis | Bloedvergiftiging op basis van een ontsteking in de buikholte |
| Ablatieve ingreep | Operatief de volledige borst verwijderen (borstamputatie) |
| Adenocarcinoom | Kanker ontstaan uit klierweefsel |
| Adjuvante therapie | Aanvullende therapie na het verwijderen van een tumor (chemotherapie, radiotherapie, hormoontherapie) |
| Amaurosis fugax | Plotseling en kortdurend met één oog niet meer kunnen zien |
| Anastomose | Darmnaad |
| Antrum | Onderste gedeelte van de maag |
| Anusatresie | Geen goede aanleg of ontbreken van de anus |
| APBI | Accelerated Partial Breast Irradiation. Alleen het gebied van de tumor wordt in een versneld tempo bestraald. |
| APR | Abdominoperineale Resectie; endeldarmresectie met aanleggen van een eindstandig stoma |
| ASA score | Score van de American Society of Anesthesiologists om conditie van de patiënt in te schatten |
| Atelectase | Een aandoening waarbij (een deel van) de long geen lucht meer krijgt en daardoor samenvalt (collaps) |
| Atriumfibrilleren | Hartritmestoornis waarbij de boezems (atria) van het hart te snel en onregelmatig samentrekken |
| Audit | Automated Data Input Terminal: Systematisch, onafhankelijk en gedocumenteerd proces om de integrale bedrijfsvoering of de resultaten van een organisatie, of van een deel ervan, te toetsen aan vooraf bepaalde criteria. De intentie van een audit is om zwakheden en fouten aan te geven om de activiteiten te verbeteren en herhaling van de zwakheden te voorkomen |
| Axilla | Oksel |
| Beschermend stoma | Tijdelijk stoma om de darmnaad te ontlasten |
| Betrouwbaarheidsinterval | Het numerieke bereik waarbinnen een onbekende geschat wordt met een zekere betrouwbaarheid |
| Bilobectomie | Verwijdering van twee longkwabben |
| Bioptie | Afname van stukje weefsel voor pathologisch onderzoek |
| BI-RADS-classificatie | Een internationale Amerikaanse score om de diagnostiek voor mammacarcinoom te classificeren (Breast Imaging Reporting and Data System-classification) |
| Body mass index | Gewicht gedeeld door de lengte in het kwadraat |
| Boost | Extra dosis radiotherapie ter plaatse van het operatiegebied |
| Borstprothese | Kunstmatige vervanging van de borst |
| Bronchopleurale fistel | Verbinding ontstaan tussen luchtwegen en borstholte |
| Bronchus | Luchtweg |
| Carcinoom | Kwaadaardige (maligne) woekering van epitheelcellen |
| Casemix | Karakteristieken van de patiëntenpopulatie |
| Charlsonscore | Comorbiditeitsscore, score waarbij een aantal specifieke comorbiditeiten een waarde krijgen toegekend. De Charlsonscore wordt gebruikt om postoperatieve sterfte te voorspellen. |
| Chemoradiatie | Gelijktijdige toediening van bestraling en chemotherapie |
| Chemotherapie | Behandeling van kanker met celdodende of celremmende middelen |
| Circumferentiële resectie marge | CRM; Marge die rondom de tumor is verwijderd |
| Colon | Dikke darm, bestaande uit het coecum, colon ascendens (rechtszijdig deel), colon transversum, colon descendens en het sigmoïd (linkszijdig deel) |
| Colon ascendens | Het opstijgende deel van de dikke darm aan de rechterkant van het lichaam |
| Colon descendens | Het neerdalende gedeelte van de dikke darm aan de linkerkant |
| Colorectaal | Dikke darm dan wel endeldarm |
| Coloscopie | Dikke darm onderzoek met camera |
| Comorbiditeit | Het tegelijkertijd aanwezig zijn van verschillende aandoeningen/stoornissen |
| Complete respons | Het verdwijnen van de symptomen van kanker en verdwijnen van sporen van kankercellen in het lichaam |
| Compliance | Volgens de norm |
| Complicatie | Ongewenste uitkomst van de behandeling |
| Cone-beam CT | CT-scan waarbij de stralen uitwaaieren tot een conus waardoor snel een beeld wordt verkregen |
| Contralateraal | De andere kant |
| Conversie | Een kijkoperatie omzetten in een open operatie |
| COPD | Chronic Obstructive Pulmonary Disease; chronische longziekte, waarbij de longen ontstoken en beschadigd zijn |
| Corpus | Het middelste gedeelte van de maag |
| CRP | C-Reactive Proteïne; acute-fase/ontstekingseiwit |
| Curatieve behandeling | Behandeling waarbij hoop is op volledige genezing |
| CVA | Cerebrovasculair accident: beroerte |
| (Primaire) Darmnaad | Het (direct) aan elkaar hechten van twee uiteinden darm na verwijdering van een darmsegment |
| Darmobstructie | Het stoppen van de darmpassage als gevolg van een obstructie (zoals een tumor) |
| Darmperforatie | Een gaatje in de darmwand, waardoor de inhoud van de darm in de buikholte kan lekken |
| Darmpoliep | Gesteelde uitpuiling van de mucosa van de darmwand |
| Decorticatie | Schoonmaken van de long- en borstkasholte |
| Diabetes | Diabetes Mellitus; suikerziekte |
| Diagnose | De vaststelling van de aard van de ziekte |
| Differentiatie tumor | De wijze waarop de kankercellen een toenemend afwijkend gedrag zijn gaan vertonen ten opzichte van de oorspronkelijke natuurlijke cellen |
| Directe borstreconstructie | Het cosmetisch reconstrueren van de borst tijdens dezelfde operatie waarbij de tumor wordt verwijderd |
| Dissectie | Het lossnijden van weefsel |
| Disseminatieonderzoek | Onderzoek naar uitbreiding/metastasering van de ziekte |
| Distale rectum | Het gedeelte van de endeldarm dat op minder dan 5 centimeter vanaf de anus ligt. |
| DCIS | Ductaal Carcinoom in Situ; een nog niet invasief groeiende kanker uitgaande van de melkgangen van de borst |
| DICA | Dutch Institute for Clinical Auditing |
| DLCO | Diffusing Capacity of the Lung for Carbon Monoxide; maat voor percentage zuurstof wat van de longen naar het bloed gaat |
| DLSA | Dutch Lung Surgery Audit, longchirurgie |
| DLRA | Dutch Lung Radiotherapy Audit, radiotherapie longkanker |
| DMTR | Dutch Melanoma Treatment Registry, melanoom |
| DPCA | Dutch Pancreatic Cancer Audit, alvleesklierkanker |
| DSAA | Dutch Surgical Aneurysm Audit, aneurysma |
| DSCA | Dutch Surgical Colorectal Audit, darmkanker |
| DUCA | Dutch Upper-GI Cancer Audit; slokdarm- en maagkanker |
| Ductaal carcinoom | Tumor uitgaande van de melkgangen van de borst |
| Ductaal carcinoom in Situ | Tumor uitgaande van de melkgangen van de borst vroeg stadium (niet-invasief) |
| DVT | Diep veneuze trombose, kuitvenetrombose |
| Dysplasie | Ongewone ontwikkeling/groei van weefsel |
| EBUS | Endoscopische Bronchiale Ultrasonografie; echo via de luchtwegen |
| Endarteriëctomie | Het binnenste deel van de halsslagader wordt verwijderd in verband met een vernauwing door vaatverkalking |
| Endovasculair | Toegang via een slagader |
| Eindstandig stoma | Het uiteinde van de darm wordt naar buiten gehaald en in de buikwand ingehecht |
| Electief | Gepland (in tegenstelling tot acuut of urgent) |
| EPSA | European Pediatric Surgical Audit |
| ER | Oestrogeen receptor |
| EUS | Endoscopische Ultrasonografie: inwendige echografie. |
| Excisie | Verwijdering, uitsnijding |
| Exclusie | Buitengesloten |
| Extramurale veneuze invasie | Tumoringroei in de bloedvaten in het omliggende vetweefsel |
| Empyeem | Pus in een reeds bestaande holte zoals de borstkas |
| Fast-track protocol | Protocol voor versneld postoperatief herstel |
| FEV1 | Het uitgeblazen longvolume tijdens de eerste seconde van de longfunctietest |
| Focaal | Haard, oorspronkelijk gebied |
| Follow-up | Controle, vervolgen |
| Frailty-index | Score voor kwetsbaarheid van de (oudere) patiënt |
| Fundus | Bovenste gedeelte van de maag |
| Funnelplot | Grafiek waarin verschillen tussen ziekenhuizen ten opzichte van elkaar worden getoond (zie ook synopsis methodologie) |
| Gastroschizis | Een aangeboren afwijking waarbij door een defect in de buikwand rechts naast de navel de ingewanden naar buiten komen |
| Galgangatresie | Een aangeboren afwijking waardoor de (grote of kleinere) galwegen in de lever niet goed zijn aangelegd |
| Hartmann procedure | Sigmoidresectie met aanleggen van een eindstandig stoma |
| HER2-receptor | Een eiwit op borstkankercellen die de gevoeligheid voor antigeen-therapie bepaalt |
| HIPEC | Hypertherme Intraperitoneale Chemotherapie; een combinatiebehandeling van chirurgie en chemotherapie, waarbij cytostatica direct worden toegediend aan het buikvlies |
| Histologisch | Weefselonderzoek |
| Hormonale therapie | Behandeling van kanker met behulp van hormonen (endocriene therapie) |
| Hormoonreceptor | Een eiwit op borstkankercellen die de gevoeligheid voor hormonale therapie bepaalt |
| Hypertensie | Hoge bloeddruk |
| I125 lokalisatie procedure | Tumorlokalisatieprocedure met jodiumzaadje |
| IGZ | Inspectie voor de Gezondheidszorg |
| Ileus | Stoppen van de normale darmpassage door een obstructie of verminderde darmperistaltiek |
| IKNL | Integraal Kankercentrum Nederland |
| IKZ | Integraal Kankercentrum Zuid |
| Immuunsuppressiva | Medicijnen om het afweersysteem te onderdrukken |
| Incidentie | Het vóórkomen van een ziekte |
| Inclusie | Ingesloten |
| Indicator | Meetbaar fenomeen met een signalerende functie die een aanwijzing geeft over de mate van kwaliteit van zorg |
| Indicatie | Reden waarom een bepaalde behandeling aangewezen is |
| Infraclaviculair | Onder het sleutelbeen |
| IORT | Intraoperatieve radiotherapie |
| Ipsilateraal | Dezelfde kant |
| Irradicaliteit | Het achterblijven van tumorweefsel na operatie |
| Klinisch stadium | Uitdrukking van de mate van uitbreiding van kanker op basis van klinisch, beeldvormend en histologisch onderzoek (vóór een eventuele operatie) |
| KWF | Koningin Wilhelmina Fonds voor de Nederlandse kankerbestrijding |
| Laesie | Afwijkend weefsel |
| Laparoscopie | Kijkoperatie van de buik |
| LAR | Low Anterior Resectie; resectie van de endeldarm |
| Lobectomie | Verwijdering van één longkwab |
| Lobulair carcinoom | Tumor uitgaande van de melkklieren van de borst |
| Locoregionaal | In hetzelfde lichaamsdeel/gebied |
| Logistische regressie | Statistisch model om de waarschijnlijkheid dat een bepaalde gebeurtenis zal plaatsvinden te voorspellen |
| Lokaal recidief | Terugkeer van de tumor na een behandeling op dezelfde locatie als eerder |
| Lymfoscintigrafie | Het voor de operatie in beeld brengen van de schildwachtklier |
| Lymfeklierstatus | De ratio tussen het aantal lymfeklieren waarin de tumor is aangetroffen en het aantal onderzochte lymfeklieren in het resectiepreparaat |
| Maligne | Kwaadaardig |
| Maligniteit | Kwaadaardige tumor |
| Mamma | Borst |
| Mammogram | Afbeelding van de borstklier met röntgenstraling |
| MammaPrint | Prognostisch genexpressieprofiel met inschatting van risicoprofiel aangaande (borstkankerspecifieke) overleving |
| MDO | Multidisciplinair overleg |
| Mediaan | Het midden van de verdeling, centrummaat |
| Mediastinum | Ruimte achter het borstbeen |
| Mediastinoscopie | Kijkoperatie achter het borstbeen |
| Melanoom | Een vorm van huidkanker die uitgaat van melanine bevattende pigment cellen of melanocyten |
| Metastase | Uitzaaiing |
| Mesorectale fascie | Vlies dat het vetweefsel rond het rectum (het mesorectum) omgeeft |
| Metastasectomieën | Verwijdering van metastasen |
| Morbiditeit | Ziekte |
| Mortaliteit | Sterfte |
| MRI-scan | Magnetic Resonance Imaging-scan |
| Multidisciplinair | Meerdere specialismen zijn betrokken bij de behandeling |
| Multifocaliteit / Multicentrisch | Aanwezigheid van meer dan één tumor in hetzelfde weefsel |
| Myocard infarct | Hartaanval |
| Naadlekkage | Het niet goed herstellen van de darmnaad, waardoor er darminhoud in de buikholte lekt |
| NABON | Nationaal Borstkanker Overleg Nederland |
| NBCA | NABON Breast Cancer Audit, mammacarcinoom |
| NBCA-jaar | Specifieke periode voor de NBCA registratie; 1 oktober – 30 september |
| Neo-adjuvante therapie | Radio-, chemo- of hormonale therapie gegeven voordat de tumor verwijderd wordt |
| NKR | Nederlandse Kankerregistratie |
| NSCLC | Niet-kleincellige vorm van longkanker |
| N-Stadium | Betrokkenheid van lymfeklieren in het geval van kanker |
| NVvH | Nederlandse Vereniging voor Heelkunde |
| Odds ratio | Statistisch gegeven dat de waarschijnlijkheid dat iets gebeurt tot de waarschijnlijkheid dat iets niet gebeurt weergeeft |
| Oesophagus | Slokdarm |
| Okselklierdissectie | Verwijdering van alle lymfeklieren van de oksel |
| Omfalokèle | Een aangeboren afwijking waarbij de ingewanden ter plaatse van de navel naar buiten puilen |
| “Open” reconstructie | Via een snee in de buik |
| PALGA | Pathologisch Anatomisch Landelijk Geautomatiseerd Archief |
| Palliatieve behandeling | Behandeling waarbij geen hoop is op volledige genezing |
| Palpabel, niet-palpabel | Voelbaar, niet voelbaar |
| Parasternaal | Naast het borstbeen |
| Parenchym | Orgaanweefsel |
| Pathologisch stadium | Uitdrukking van de mate van uitbreiding van kanker op basis van onderzoek van het verwijderde weefsel dat verkregen werd bij de operatie |
| Percutaan | Door de huid |
| Peritonitis | Ontsteking van het buikvlies |
| PET-scan | Positron Emission Tomography scan: beeldvormend onderzoek waarbij veranderingen in de stofwisseling van cellen in beeld worden gebracht met behulp van een kleine hoeveelheid radioactieve stof en een speciale scanner |
| Plaveiselcelcarcinoom | Kanker ontstaan uit plaveiselcellen, een cellaag die bijvoorbeeld de huid maar ook de slokdarm bekleedt. |
| Pleura | Vliezen die zowel de long als de borstholte bekleden |
| Pneumectomie | Verwijdering van gehele long |
| Pneumonie | Longontsteking |
| Pneumothorax | Klaplong |
| Postmortem | Na overlijden |
| Postoperatief | Na de operatie |
| PR | Progesteron-receptor |
| Prestatie-indicator | Een kwantificeerbare, meetbare indicatie die laat zien of een organisatie erin geslaagd is een bepaalde doelstelling te bereiken. |
| Preoperatief | Voorafgaand aan de operatie |
| Primaire tumor | Oorspronkelijke tumor die de oorzaak is van de kanker |
| Procesindicator | Een meetbaar aspect van zorg dat een indicatie geeft over het verloop van processen in een organisatie |
| Profylactische resectie | Het preventief verwijderen van een orgaan of weefsel vanwege een verhoogd risico op het ontstaan van een aandoening |
| Prognose | Voorspelling of verwachting hoe het ziekte beloop zal zijn |
| Pylorus | Laatste gedeelte van de maag waar de sluitspier van de maag zich bevindt, vlak voor de overgang naar de dunne darm |
| Quality-adjusted life years | Aantal levensjaren vermenigvuldigd door een correctiefactor voor de kwaliteit van die levensjaren (1 QALY = 1 gezond levensjaar) |
| R0-resectie | Aanduiding dat een tumor volledig is verwijderd, bevestigd door microscopisch pathologisch onderzoek |
| R1-resectie | Aanduiding dat er bij microscopisch onderzoek aanwijzingen zijn dat een tumor niet in zijn geheel verwijderd is |
| R2-resectie | Aanduiding dat met het blote oog tijdens de operatie al zichtbaar is dat een tumor niet in zijn geheel is verwijderd |
| Radicaliteit | Mate van volledigheid in het verwijderen van een tumor |
| Radioactieve jodiumbron | Een techniek om tumoren die niet voelbaar zijn te lokaliseren |
| Radiotherapie | Bestraling |
| Recidief | Terugkeer van ziekte, op oorspronkelijke locatie (lokaal) dan wel in de buurt (regionaal) |
| Rectum | Endeldarm |
| Re-excisie | Een tweede operatieve verwijdering van een afwijking |
| RFA | Radio Frequency Ablation |
| Reïnterventie | Een ongeplande ingreep na de eerste operatie (kan zowel radiologisch als chirurgisch zijn) |
| Resectie | Verwijdering |
| ROLL | Radio Guided Occult Lesion Localisation; een techniek om tumoren die niet voelbaar zijn te lokaliseren |
| Ruptuur | Gebarsten |
| Salvage chirurgie | Chirurgie voor een tumor die lokaal is teruggekomen na een eerdere operatie, met als voornaamste doel om de lokale (tumor) controle te herstellen of behouden |
| Schildwachtklierprocedure | De schildwachtklier verwijderen en laten onderzoeken. Schildwachtklier of poortwachtersklier is de eerste klier in de keten van lymfeklieren waarin tumorcellen worden opgevangen. |
| Segmentresectie | Verwijdering van een deel (segment) van een orgaan |
| Sigmoid | Het S-vormige gedeelte van de darm dat is gelegen tussen de dikke darm en de endeldarm |
| Significant | Statistisch van betekenis, omdat het verschijnsel vaker voorkomt dan volgens de kansberekening binnen de grenzen van het toeval mogelijk is |
| Sleeve resectie | Verwijdering van een stuk long met luchtpijp |
| Slokdarmatresie | Aangeboren afwijking waarbij de aansluiting van de keel naar de maag is afgesloten |
| Solide laesie | Vast gezwel |
| SONCOS | Stichting Oncologische Samenwerking |
| Stadiëring | Onderzoek om tumorstadium vast te stellen |
| Stereotactische bestraling | Heel nauwkeurige bestraling vanuit verschillende richtingen waardoor een hoge bestralingsdosis gegeven kan worden, terwijl het omliggende weefsel tot op de millimeter nauwkeurig wordt gespaard |
| Stereotactische bioptie | Een biopsieprocedure waarbij een computer en een 3-dimensionale scanner gebruikt worden om een tumorgebied te vinden en het wegnemen van weefsel voor onderzoek onder een microscoop te geleiden |
| Supraclaviculair | Boven het sleutelbeen |
| Supraventriculaire ritmestoornissen | Vorm van hartritmestoornis |
| Symptomatische carotisstenose | Vernauwing in een slagader in de hals waardoor de patiënt de kenmerken van een TIA/ herseninfarct ineens ervaart |
| Synchrone tumor | Tumor die zich op hetzelfde moment presenteert als een andere tumor |
| Systemische therapie | Een behandeling die het gehele lichaam aanpakt, bijv. chemotherapie, hormonale therapie of immunotherapie. |
| Tachycardie | Een hartritme waarbij het hart klopt met een frequentie van meer dan 100 slagen per minuut |
| TEM | Transanale endoscopische microchirurgie; het verwijderen van een afwijking in de endeldarm via de anus met behulp van uitvergroot beeld |
| Thoracoscopie | Kijkoperatie van de borstholte |
| Thoracotomie | Operatie waarbij de ribben gespreid worden om bij de long te komen |
| Thoraxwand | Borstkaswand |
| TIA | Transient Ischemic Attack: kortdurende voorbijgaande beroerte |
| TME | Totale Mesorectale Excisie. Standaardprocedure voor verwijdering van een endeldarmtumor, waarbij ook het omliggend vetweefsel en bindweefselblad (mesorectale fascie) wordt verwijderd |
| Toxiciteit | Giftigheid; Werkzaamheid van een stof waardoor de fysiologische processen in een organisme in een voor dat organisme ongunstige zin beïnvloed worden |
| Transhiatale | Het operatief verwijderen van de slokdarm en het bovenste stukje van de maag vanuit |
| oesophaguscardiaresectie | de buikholte via de opening in het middenrif |
| Transthoracale | Het operatief verwijderen van de slokdarm en het bovenste stukje van de maag via de |
| oesophaguscardiaresectie | borstholte |
| Treeknorm | 80% van de patiënten dient binnen 5 weken na diagnose gestart te zijn met enige vorm van behandeling, en 100% binnen 7 weken |
| Triple negatief | Tumor zowel negatief voor de oestrogeen, progesteron receptoren als de HER2-status |
| Tumorload | Hoeveelheid tumorcellen |
| Tumorstadium | Maat voor de uitgebreidheid van de tumor, de lymfklieruitzaaiing en uitzaaiingen op afstand |
| Uitkomstindicator | Meetbaar aspect van zorg dat een indicatie geeft over de uitkomst van de zorg |
| Valide | Geldig (met andere woorden: de uitkomsten van het onderzoek, komen overeen met de werkelijkheid) |
| VATS | Video-assisted thoracoscopic surgery: kijkoperatie van de borstholte |
| Volumenorm | Verplichting voor een ziekenhuis om een behandeling minimaal x aantal keer per jaar uit te voeren om deze te mogen aanbieden |
| Vriescoupe | Snel onderzoek van weefsel tijdens de operatie, door middel van bevriezing van het weefsel. |
| Wait and see-procedure | Afwachtend beleid na neo-adjuvante therapie |
| Wigresectie | verwijdering van een kleine hoeveelheid longweefsel zonder rekening te houden met de anatomische grenzen |
| Zegelringtumor | Type adenocarcinoom |
| Zichtbare Zorg Ziekenhuizen | Samenwerkende organisaties binnen de zorgsector ziekenhuizen |
| Ziekte van Hirschsprung | Aangeboren zenuwaandoening van de dikke darm waarbij het samentrekkingspatroon (peristaltiek) niet aanwezig is of niet goed functioneert |
| Z-lijn | De overgang van de slokdarm naar de maag, zichtbaar omdat deze door verschillende celtypen worden bekleed |
Over DICA
DICA registreert kwaliteit van de zorg. Daaronder vallen op dit moment bijvoorbeeld wachttijden, het naleven van richtlijnen, duur van een ziekenhuisopname en sterfte na een operatie. DICA faciliteert en de beroepsverenigingen bepalen de inhoud.
Uniek Systeem
Uniek aan het systeem is de wekelijkse online terugkoppeling met een landelijke benchmark. Zo kunnen behandelaars hun resultaten vergelijken met die van andere ziekenhuizen en weten zij direct op welke punten zij hun zorg moeten verbeteren. Daarnaast houdt het systeem rekening met ‘zorgzwaarte’: sommige ziekenhuizen behandelen nu eenmaal ingewikkelder patiënten, waardoor zij in absolute zin misschien minder goed scoren maar niet noodzakelijkerwijs slechter zijn. Dit wordt gecorrigeerd en dat is de enige manier waarop de resultaten tussen ziekenhuizen echt goed vergelijkbaar zijn.
Registraties
DICA heeft op dit moment de volgende lopende deelregistraties:
- Darmkanker (DSCA)
- Borstkanker (NBCA)
- Maag- en slokdarmkanker (DUCA)
- Longchirurgie (DLSA)
- Aneurysmachirurgie (DSAA)
De volgende deelregistraties zijn in de pilotfase of beginnen hier binnenkort aan:
- Melanoom (DMTR)
- Longkanker-radiotherapie (DLRA)
- Pancreaskanker (DPCA)
- Kinderchirurgie (EPSA)
Deelregistraties in ontwikkeling met opstart in 2013:
- Bariatrie (DATO)
- Gynaecologische oncologie (DGOA)
- Spinale chirurgie (DSSR)
- Behandeling CVA (CVAB)
- Behandeling Parkinson
- Carotis chirurgie (DACI)
- Hepatobilaire chirurgie (DHBA)
Organisatie
Bestuur DICA
- Prof. dr. R.A.E.M. Tollenaar, voorzitter
- Dr. H.A. Prins (namens commissie Uitkomst van Zorg, NVvH), lid
- Prof. dr. Ir. J.J.M. van der Hoeven (namens SONCOS), lid
- Dr. M.T.F.D. Vrancken Peeters (namens werkgroep audit NVvH), lid
- Prof. dr. E.J. Kuipers (namens NVMDL), lid
- Prof. dr. P.M. Kluin (namens NVvP), lid
Bureau DICA
- Dr. E.H. Eddes, directeur
- Dr. M.W.J.M. Wouters, hoofd wetenschappelijk bureau
- Drs. N.J. Van Leersum, medisch manager kwaliteitsregistraties
Arts-onderzoekers
- Drs. H.S. Snijders
- Drs. D. Henneman
- Drs. M. Ten Berge
- Drs. A.C.M. van Bommel
- Drs. L. Gietelink
- Drs. N. Lijftogt
Bestuursleden registraties
- Dutch Surgical Colorectal Audit (DSCA)
- Prof. dr. T. Wiggers, voorzitter
- Prof. dr. C.J.H. van de Velde (namens DCCG), vice-voorzitter
- Prof. dr. R.A.E.M. Tollenaar, voorzitter wetenschappelijke commissie
- Dr. M.W.J.M. Wouters (namens NVCO), lid
- Dr. Th.M. Karsten (namens NVGIC) , lid
- Dutch Upper GI Cancer Audit (DUCA)
- Dr. J.W. van Sandick (namens DGCG), voorzitter
- Dr. B.P.L. Wijnhoven, (namens DOCG), secretaris
- Prof. Dr. R. Van Hillegersberg, (namens NVGIC), penningmeester
- NABON Breast Cancer Audit (NBCA)
- Prof. dr. V.C.G. Tjan-Heijnen (namens NABON en NVMO), voorzitter
- Dr. T. van Dalen (namens NVCO), secretaris
- Prof. dr. H. Struikmans (namens NVRO), lid
- Dr. P.J. Westenend, patholoog (namens NVvP), lid
- Dutch Lung Surgery Audit (DLSA)
- Dr. J.P. Eerenberg (namens NVvL),voorzitter
- Dr. W.H. Steup (namens NVvL), secretaris
- Dr. P.W. Plaisier (namens NVvL), penningmeester
- Dr. P.H.J.M. Veldman (namens NVvL), voorzitter wetenschappelijke commissie
- Dr. J. Siebenga, (namens NVvL), lid
- Dutch Surgical Aneurysm Audit (DSAA)
- Dr. B.H.P. Elsman, voorzitter
- Prof. dr. J.F. Hamming, lid
- Prof. dr. D.A. Legemate, lid
- Dutch Lung Radiotherapy Audit (DLRA)
- Dr. J.S.A. Belderbos, voorzitter
- Dr. ir. A. Dekker, lid
- Dr. J. Bussink, lid
- European Pediatric surgical Audit (EPSA)
- Prof. dr. L.W.E. van Heurn, voorzitter
- Dr. J.B.F. Hulscher, lid
- Prof. dr. R.M.H. Wijnen, lid
- Prof. dr. D.C. van der Zee, lid
- Dutch Pancreatic Cancer Audit (DPCA)
- Prof. dr. O.R.C. Busch (namens DPCG), voorzitter
- Dr. B. Groot Koerkamp, lid
- Dr. M. Besselink, lid
DICA stelt binnenkort een Adviesraad in. Voorzitter Wim Schellekens over de vertrouwenscrisis in de gezondheidszorg, het bedwingen van de kosten ervan en de rol die DICA daarbij kan spelen.
“We hebben de laatste jaren teveel crises gehad”, stelt Wim Schellekens. Als voorbeeld noemt hij de gevaarlijke multiresistente Klebsiellabacterie in het Maasstad Ziekenhuis in Rotterdam en de problemen op de cardiologie-afdeling in het Ruwaard van Putten Ziekenhuis in Spijkenisse. De patiënt vraagt zich steeds vaker af: Ben ik wel veilig in het ziekenhuis? Is mijn dokter deskundig genoeg? Patiënten beseffen dat de zorg niet overal even goed is. “Het antwoord op deze vertrouwenscrisis is transparantie. DICA maakt de kwaliteit van de zorg transparant en kan dus helpen het vertrouwen in de zorg te herstellen”, aldus Schellekens. Hij ging in 2011 met pensioen en zet zich sindsdien in voor innovaties die de zorg voor de patiënt beter, veiliger en betaalbaar maken.
Registratielast
Schellekens: “Het mooie van de DICA-registraties is dat ze gedragen worden door de beroepsgroep zelf en dat de registraties structureel onderdeel zijn van het zorgproces. Vrijwillige transparantie versterkt het vertrouwen, terwijl afgedwongen transparantie dit juist ondermijnt. Wanneer je bij een crisis pas na aandringen informatie verstrekt, is het vertrouwen al weg.”
Schellekens wijst er wel op dat er een balans moet zijn in het streven naar volledige transparantie en de registratielast. De beroepsgroep die actief betrokken is bij de opzet van de registratie is extra geïnteresseerd en wil er veel items in opnemen. Het gevaar hiervan is dat de registratielast te hoog wordt, waardoor artsen afhaken. “Afdwingen werkt niet”, vindt Schellekens die zijn sporen in de gezondheidszorg heeft verdiend. Hij begon zijn loopbaan als huisarts. Daarna werd hij: medisch adviseur Ziekenfondsraad, directeur patiëntenzorg van het ziekenhuis in Delft, directeur van het Kwaliteitsinstituut voor de Gezondheidszorg CBO en hoofdinspecteur bij Inspectie voor de Gezondheidszorg.
Best practices
Een ander maatschappelijk thema: de kosten van de gezondheidszorg. “Betere en veiligere zorg is goedkopere zorg. Complicaties, zoals wondinfecties en heroperaties, zijn kostbaar. Ook bij verbetering van logistieke processen in ziekenhuizen gaan kwaliteitsverhoging en kostenverlaging hand in hand”, legt Schellekens uit. In een goed proces hoeven foto’s bijvoorbeeld maar een keer gemaakt te worden en zijn wachttijden korter. Deze zogenoemde procesindicatoren zijn, net als uitkomstindicatoren, onderdeel van de DICA-registraties, waardoor de best practices in het optimaal organiseren van de zorg zichtbaar worden. Andere ziekenhuizen kunnen hiermee hun voordeel doen.
Schellekens vindt dat de best practices de maatstaf moeten zijn bij het stellen van kwaliteitsnormen in de zorg. “Alle ziekenhuizen hebben in principe evenveel kennis, mensen en geld. Wat de beste 10-20% van de ziekenhuizen kan, kunnen in principe alle ziekenhuizen. Het gaat erom dat ziekenhuizen moeten doen waarvan bekend is dat het werkt.”
Ervaringen van de patiënt
Volgens Schellekens hebben de DICA-registraties nu al een aantal jaar bewezen dat ze in de praktijk werken. “Ze leveren valide en betrouwbare informatie op, waardoor de ziekenhuizen te vergelijken zijn.” DICA blijft zich verder ontwikkelen: het aantal registraties neemt toe en voorbereidingen zijn getroffen om naast de professionele indicatoren ook de ervaringen van de patiënt op te nemen in de registratie. De DSCA start hiermee in 2013. Vooral in de palliatieve fase moeten patiënten keuzen maken. Het almaar doorbehandelen wanneer er geen kans meer is op genezing, is bijvoorbeeld steeds minder vanzelfsprekend voor veel patiënten. Schellekens: “DICA spiegelt voor hoe de verschillende ziekenhuizen met dit soort zaken omgaan. Hierdoor kan DICA een stimulans zijn om de zorg verder te verbeteren.”
De Nederlandse Patiënten Consumenten Federatie vindt DICA een prima initiatief van de dokters. De organisatie juicht het toe dat DICA nu ook start met de registratie van ervaringen van patiënten. Patiënten en artsen zijn het er immers niet altijd over eens of een ingreep is geslaagd.
“Patiënten vinden soms andere zaken belangrijk dan de arts”, stelt Wilna Wind. “Een darmtumor kan bijvoorbeeld uitstekend zijn verwijderd, er is geen naadlekkage en er treden geen complicaties op: de operatie is technisch gezien geslaagd. Toch kan de ingreep en het herstel voor bijvoorbeeld een oudere of dementerende patiënt een drama zijn. Een patiënt kijkt vooral naar het resultaat: is de kwaliteit van mijn leven verbeterd? Mensen denken wel eens dat patiënttevredenheid alleen gaat over de vriendelijkheid en het begrip van een arts. Ook dat is een belangrijk onderdeel van het werk van een arts, maar patiënttevredenheid gaat eveneens over de zorg zelf en de uitkomsten daarvan.”
Wind vindt het positief dat DICA in 2012 gestart is met de voorbereidingen van een PROMs-module voor de DSCA. Hierbij is de Nederlandse Federatie Kankerpatiënten (NFK), een lidorganisatie van de NPCF, nauw betrokken geweest. “Een mooi voorbeeld van een samenwerking tussen beroepsgroepen en een patiëntenvereniging”, aldus Wind.
Keuze-informatie
DICA is nu nog een instrument dat artsen gebruiken om kwaliteit te meten en inzichtelijk te maken. Het levert nog geen keuze-informatie op voor de patiënt. Wind zou dit wel een goede zaak vinden. “Als patiënt wil je weten waar de beste zorg wordt geleverd voor je aandoening. We weten inmiddels dat niet elke arts even goed is. Openheid over kwaliteit drukt eventuele misstanden de kop in. Dokters die bovenop de informatie over kwaliteit blijven zitten, bewijzen daarmee niemand een dienst.” Wind wil zeker niet de indruk wekken dat de zorg in Nederland een aaneenschakeling is van misstanden. “Dat is natuurlijk onzin. Er zijn genoeg goede dokters.” Om deze reden verwacht Wind geen ellenlange wachtlijsten wanneer er meer informatie is over de kwaliteit van zorg in de verschillende ziekenhuizen. Zij vreest dat weinig informatie juist lange wachtlijsten in de hand werkt. “Dan raden patiënten anderen een arts aan enkel op basis van hun eigen ervaring of verhalen die rond gaan. Zo was ex-neuroloog Ernst Jansen Steur bijvoorbeeld een populaire arts waarvoor patiënten in de rij stonden.”
Meewerken
Denkt u dat patiënten bereid zijn hun ervaringen toe te vertrouwen aan een kwaliteitsregistratiesysteem? “Ja, de meeste mensen die kanker hebben, willen hun ervaringen delen en werken graag mee aan verbetering van de zorg en overleving van kanker. Voor henzelf, maar ook voor andere patiënten.”
Zorgverzekeraars Nederland vindt dat kwaliteitsregistratie een vast onderdeel moet worden van het werk van medisch specialisten. Zover is het nog niet. Daarom biedt de brancheorganisatie van de Nederlandse zorgverzekeraars financiële steun aan tien DICA-registraties.
“Het zou heel normaal moeten zijn dat medisch specialisten zichzelf en elkaar een spiegel voorhouden”, aldus André Rouvoet. “Zo wordt hun deskundigheid bevorderd en wordt de kwaliteit van de zorg transparant. Het introduceren van een kwaliteitsregistratiesysteem kost tijd en geld en daarom ondersteunen we het initiatief van DICA graag. We zijn nog steeds tevreden over de samenwerking die we in 2012 voor drie jaar met elkaar zijn aangegaan.”
Transparantie
Rouvoet stelt dat het verbeteren van de kwaliteit van de zorg voorop staat bij klinische registraties zoals de DICA. “Het gaat om levens sparen door betere zorg. Bezuinigingen zijn niet het doel, want daarvoor heb je andere middelen, zoals het aanpakken van fraude of het efficiënter organiseren van zorgprocessen. Uiteraard kost goede zorg wel minder, doordat er bijvoorbeeld minder complicaties zijn en minder mensen langdurig in een verpleeghuis komen.”
In de toekomst willen zorgverzekeraars de resultaten van de DICA-registratie gebruiken bij het inkopen van zorg in de ziekenhuizen. Rouvoet benadrukt dat de DICA-uitkomsten gebruikt worden als basis voor een gesprek met ziekenhuizen. “Deze gesprekken bieden openingen voor betere en efficiëntere zorg. Er kan bijvoorbeeld besproken worden waarom patiënten in het ene ziekenhuis gemiddeld vijf dagen blijven na een behandeling, terwijl dit in andere ziekenhuizen slechts drie dagen is. Met de cijfers uit de DICA-registratie is het mogelijk zo’n verschil te onderzoeken en wellicht uit te leggen. Ziekenhuizen hebben dus zelf ook belang bij transparantie.”
Concentratie en spreiding
De tendens is dat zorgverzekeraars bij het inkopen van zorg, naast het volume en de prijs, steeds meer op kwaliteit letten. Het gevolg hiervan kan zijn dat niet elk ziekenhuis meer alle behandelingen uitvoert. Moeten patiënten vrezen voor het verdwijnen van goede zorg in de buurt? Rouvoet: “Het kan zijn dat men voor bepaalde gespecialiseerde behandelingen verder moet gaan reizen. Dat mensen met ernstige brandwonden aangewezen zijn op enkele centra in Nederland, waaronder het brandwondencentrum in Beverwijk, is bekend en geaccepteerd. Dat zal met meer behandelingen gaan gebeuren en ik verwacht dat men dit over twintig jaar heel gewoon vindt. Gespecialiseerde centra ontstaan spontaan of doordat zorgverzekeraars er druk op zetten. Voor alle duidelijkheid: zorgverzekeraars sluiten geen ziekenhuizen of afdelingen van ziekenhuizen. Zij kunnen hooguit besluiten om ondermaatse of te dure zorg niet in te kopen. Basiszorg moet uiteraard wel verspreid over Nederland beschikbaar blijven.”
Patiëntervaringen
Zorgverzekeraars Nederland wil kwaliteit in de zorg bevorderen en deze transparant maken. Naast het stimuleren van klinische registratie wil de brancheorganisatie ook graag feedback over de kwaliteit die de patiënt ervaart. “Daarom werken we met de zogenoemde Client Quality-indexen en PROMs waarmee we kunnen achterhalen wat patiënten en cliënten belangrijk vinden in de zorg én wat hun concrete ervaringen zijn. DICA voegt dit jaar een PROMs-module toe aan de DSCA-registratie. Dat is een goede zaak, net als de uitbreidingen van het aantal registraties voor diverse andere oncologische aandoeningen. Kortom, we zijn enthousiast over de route die DICA volgt, reden waarom we er graag medefinancier van zijn. Uiteraard blijft Zorgverzekeraars Nederland open staan voor goede initiatieven in de zorg, maar een wildgroei van allerlei registraties moeten we vermijden.”

Colofon
Dit rapport werd geschreven in opdracht van het Bestuur en onder auspiciën van de Wetenschappelijke Commissies van de Dutch Surgical Colorectal Audit (DSCA), NABON Breast Cancer Audit (NBCA), Dutch Upper GI Cancer Audit (DUCA), Dutch Lung Surgery Audit (DLSA), European Pediatric Surgical Audit (EPSA), Dutch Lung Radiotherapy Audit (DLRA), Dutch Surgical Aneurysm Audit en Dutch Audit for Carotid Interventions (DSAA/DACI), Dutch Melanoma Treatment Registry (DMTR) en Dutch Pancreatic Cancer Audit (DPCA).
Analyses en eindredactie:
Dr. M.W.J.M. Wouters, chirurg, Nederlands Kanker Instituut- Antoni van Leeuwenhoek ziekenhuis, Amsterdam; hoofd wetenschappelijk bureau Dutch Institute for Clinical Auditing, Leiden
Drs. M. ten Berge, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Mw. drs. A.C.M. van Bommel, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Dr. T. van Dalen, chirurg, Diakonessenhuis, Utrecht
Dr. E.H. Eddes, chirurg, Deventer Ziekenhuis, Deventer; directeur Dutch Institute for Clinical Auditing, Leiden
Dr. J.P. Eerenberg, chirurg, Tergooiziekenhuizen, Hilversum
Mw. drs. L. Gietelink, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Mw. dr. M. van der Heiden-van der Loo, epidemioloog, IKNL (Integraal Kankercentrum Nederland)
Drs. D. Henneman, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Mw. drs. N.J. van Leersum, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Mw. drs. N. Lijftogt, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Mw. dr. J.W. van Sandick, chirurg, Nederlands Kanker Instituut- Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
Mw. drs. H.S. Snijders, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Dr. P.J. Tanis, chirurg, Academisch Medisch Centrum, Amsterdam
Mw. prof. dr. V.C.G. Tjan-Heijnen, hoogleraarMedische Oncologie, Maastricht Universitair Medisch Centrum, Maastricht
Prof. dr. R.A.E.M. Tollenaar, hoogleraar Oncologische Chirurgie, Leids Universitair Medisch Centrum, Leiden; voorzitter Bestuur Dutch Institute for Clinical Auditing, Leiden
Dr. P.H.J. M. Veldman, chirurg, ziekenhuis De Tjongerschans, Heerenveen
Prof. dr. T. Wiggers, Emeritus hoogleraar Oncologische Chirurgie, Universitair Medisch Centrum Groningen, Groningen
Dr. B.P.L. Wijnhoven, chirurg, Erasmus Medisch Centrum, Rotterdam
Redactie DSCA
Prof. dr. R.A.E.M. Tollenaar, hoogleraar Oncologische Chirurgie, Leids Universitair Medisch Centrum, Leiden; voorzitter Bestuur Dutch Institute for Clinical Auditing, Leiden
Drs. M. ten Berge, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Mw. dr. D. Boerma, chirurg, St. Antonius Ziekenhuis, Nieuwegein
Dr. J.W. Dekker, chirurg, Reinier de Graaf Groep, Delft
Mw. dr. M.A Elferink, onderzoeker, IKNL (Integraal Kankercentrum Nederland), Enschede
Mw. drs. L. Gietelink, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Drs. D. Henneman, arts-onderzoeker, Leids Universitair Medisch Centrum, Leiden
Prof. dr. J.H.J.M. van Krieken, hoogleraar Pathologie, Universitair Medisch Centrum St. Radboud, Nijmegen
Dr. E.R. Manusama, chirurg, Medisch Centrum Leeuwarden
Mw. dr. M.E. de Noo, chirurg, Deventer Ziekenhuis, Deventer
Mw. drs. H.S. Snijders, arts-onderzoeker, Leids Universitair Medisch Centrum, Leiden
Dr. P.J. Tanis, chirurg, Academisch Medisch Centrum, Amsterdam
Prof. dr. T. Wiggers, Emeritus hoogleraar Oncologische Chirurgie, Universitair Medisch Centrum Groningen
Dr. M.W.J.M. Wouters, chirurg, Nederlands Kanker Instituut- Antoni van Leeuwenhoek ziekenhuis, Amsterdam; hoofd wetenschappelijk bureau Dutch Institute for Clinical Auditing, Leiden
Wetenschappelijke commissie DSCA
Dr. A.G.J. Aalbers, chirurg, Nederlands Kanker Instituut- Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
Prof. Dr. W.A. Bemelman, hoogleraar Minimaal invasieve Chirurgie, Academisch Medisch Centrum, Amsterdam
Mw. dr. D. Boerma, chirurg, St. Antonius Ziekenhuis, Nieuwegein
Dr. R.M. van Dam, chirurg, Maastricht Universitair Medisch Centrum, Maastricht
Dr. J.W. Dekker, chirurg, Reinier de Graaf Groep, Delft
Dr. E.H. Eddes, chirurg, Deventer Ziekenhuis, Deventer; directeur Dutch Institute for Clinical Auditing, Leiden
Mw. dr. M.A Elferink, onderzoeker, IKNL (Integraal Kankercentrum Nederland), Enschede
Dr. E. van der Harst, chirurg, Maasstad ziekenhuis, Rotterdam
Dr. T.M. Karsten, chirurg, Onze Lieve Vrouwe Gasthuis, Amsterdam
Prof. dr. J.H.J.M. van Krieken, hoogleraar Pathologie, Universitair Medisch Centrum St. Radboud, Nijmegen
Dr. V.E.P.P. Lemmens, epidemioloog, Hoofd Sector Onderzoek, IKNL (Integraal Kankercentrum Nederland), en Sectie Cancer Surveillance, Afdeling Maatschappelijke Gezondheidszorg, Erasmus Medisch Centrum, Rotterdam
Dr. E.R. Manusama, chirurg, Medisch Centrum Leeuwarden, Leeuwarden
Dr. W.J.H.J. Meijerink, chirurg, VU Medisch Centrum, Amsterdam
Mw. dr. M.E. de Noo, chirurg, Deventer Ziekenhuis, Deventer
Prof. dr. H.J.T. Rutten, hoogleraar Oncologische Chirurgie, Catharina ziekenhuis, Eindhoven
Prof. dr. R.A.E.M. Tollenaar, hoogleraar Oncologische Chirurgie, Leids Universitair Medisch Centrum, Leiden; voorzitter Bestuur Dutch Institute for Clinical Auditing, Leiden
Prof. dr. C.J.H. van de Velde, hoogleraar Oncologische Chirurgie, Leids Universitair Medisch Centrum, Leiden
Prof. dr. T. Wiggers, Emeritus hoogleraar Oncologische Chirurgie, Universitair Medisch Centrum Groningen, Groningen
Dr. M.W.J.M. Wouters, chirurg, Nederlands Kanker Instituut- Antoni van Leeuwenhoek ziekenhuis, Amsterdam; hoofd wetenschappelijk bureau Dutch Institute for Clinical Auditing, Leiden
Redactie NBCA
Mw. drs. A.C.M. van Bommel, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Dr. T. van Dalen, chirurg, Diakonessenhuis, Utrecht
Mw. dr. M. van der Heiden-van der Loo, epidemioloog, IKNL (Integraal Kankercentrum Nederland), Utrecht
Mw. dr. A. Jager, internist-oncoloog, Erasmus MC-Daniel den Hoed, Rotterdam
Dr. J.M. Maduro, radiotherapeut, Universitair Medisch Centrum Groningen, Groningen
Dr. M.A.M. Mureau, plastisch en reconstructief chirurg, Erasmus Medisch Centrum, Rotterdam
Mw. dr. S. Siesling, epidemioloog, IKNL (Integraal Kankercentrum Nederland), Enschede
Mw. dr. C.H. Smorenburg, internist-oncoloog, Medisch Centrum Alkmaar, Alkmaar
Mw. drs. H.S. Snijders, arts-onderzoeker, Leids Universitair Medisch Centrum, Leiden
Prof. dr. H. Struikmans, hoogleraar Radiotherapie, MCH Westeinde, Den Haag
Mw. prof. dr. V.C.G. Tjan-Heijnen, hoogleraarMedische Oncologie, Maastricht Universitair Medisch Centrum, Maastricht
Mw. Dr. M.T.F.D. Vrancken Peeters, chirurg, Nederlands Kanker Instituut- Antoni van Leeuwenhoek ziekenhuis, Amsterdam
Dr. P.J. Westenend, patholoog, pathologisch laboratorium voor Dordrecht e.o., Dordrecht
Wetenschappelijk commissie NBCA
Mw. drs. A.C.M. van Bommel, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Dr. T. van Dalen, chirurg, Diakonessenhuis, Utrecht
Mw. G. van der Heide-Schoon, Borstkanker Vereniging Nederland
Mw. dr. M. van der Heiden-van der Loo, epidemioloog,IKNL (Integraal Kankercentrum Nederland), Utrecht
Dhr. H. Hummel, senior advies netwerken, IKNL (Integraal Kankercentrum Nederland), Amsterdam
Mw. dr. A. Jager, internist-oncoloog, Erasmus MC-Daniel den Hoed, Rotterdam
Dr. J.M. Maduro, radiotherapeut, Universitair Medisch Centrum Groningen, Groningen
Dr. M.A.M. Mureau, plastisch en reconstructief chirurg, Erasmus Medisch Centrum, Rotterdam
Prof. dr. E.J.Th. Rutgers, hoogleraar Oncologische Chirurgie, Nederlands Kanker Instituut- Antoni van Leeuwenhoek ziekenhuis, Amsterdam
Mw. M. Schrieks, Borstkanker Vereniging Nederland
Mw. dr. S. Siesling, epidemioloog, IKNL (Integraal Kankercentrum Nederland), Enschede
Mw. dr. C.H. Smorenburg, internist-oncoloog, Medisch Centrum Alkmaar, Alkmaar
Prof. dr. H. Struikmans, hoogleraar Radiotherapie, MCH Westeinde, Den Haag
Mw. prof. dr. V.C.G. Tjan-Heijnen, hoogleraarMedische Oncologie, Maastricht Universitair Medisch Centrum, Maastricht
Mw. dr. M.T.F.D. Vrancken Peeters, chirurg,Nederlands Kanker Instituut- Antoni van Leeuwenhoek ziekenhuis, Amsterdam
Dr. P.J. Westenend, patholoog, pathologisch laboratorium voor Dordrecht e.o., Dordrecht
Dr. M.W.J.M. Wouters, chirurg, Nederlands Kanker Instituut- Antoni van Leeuwenhoek ziekenhuis, Amsterdam; hoofd wetenschappelijk bureau Dutch Institute for Clinical Auditing, Leiden
Mw. A. Zaat, Borstkanker Vereniging Nederland
Redactie DUCA
Dr. M.I. van Berge Henegouwen, chirurg, Academisch Medisch Centrum, Amsterdam
Mw. dr. A. Cats, maag-darm-leverarts, Nederlands Kanker Instituut- Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
Dr. J.L. Dikken, chirurg in opleiding, Leids Universitair Medisch Centrum, Leiden / Medisch Centrum Haaglanden, den Haag
Mw. dr. N.C.T. van Grieken, patholoog, VU Medisch Centrum, Amsterdam
Drs. D. Henneman, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Dr. V.E.P.P. Lemmens, epidemioloog, IKZ (Integraal Kankercentrum Zuid)
Dr. G.A.P. Nieuwenhuijzen, chirurg, Catharina Ziekenhuis, Eindhoven
Dr. T. Rozema, radiotherapeut, Verbeeten Instituut, Tilburg
Mw. dr. J.W. van Sandick, chirurg, Nederlands Kanker Instituut- Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
Mw. Dr. J.Steevens, epidemioloog, IKNL (Integraal Kankercentrum Nederland), Maastricht
Ing. P.M.J.F. Veldhuis, IKNL (Integraal Kankercentrum Nederland), Enschede/Groningen, projectmanager Managed Clinical Networks
Dr. B.P.L. Wijnhoven, chirurg, Erasmus Medisch Centrum, Rotterdam
Wetenschappelijke commissie DUCA
Dr. M.I. van Berge Henegouwen, chirurg, Academisch Medisch Centrum, Amsterdam, voorzitter wetenschappelijke commissie
Dr. K. Bosscha, chirurg, Jeroen Bosch Ziekenhuis, Den Bosch
Mw. dr. A. Cats, maag-darm-leverarts, Nederlands Kanker Instituut- Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
Dr. J.L. Dikken, chirurg in opleiding, Leids Universitair Medisch Centrum, Leiden / Medisch Centrum Haaglanden, den Haag
Mw. dr. N.C.T. van Grieken, patholoog, VU Medisch Centrum, Amsterdam
Dr. H.H. Hartgrink, chirurg, Leids Universitair Medisch Centrum, Leiden
Drs. D. Henneman, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Dr. P.C. de Jong, medisch oncoloog, St. Antonius Ziekenhuis, Nieuwegein
Dr. V.E.P.P. Lemmens, epidemioloog, IKZ (Integraal Kankercentrum Zuid)
Dr. G.A.P. Nieuwenhuijzen, chirurg, Catharina Ziekenhuis, Eindhoven
Prof. dr. J.T. Plukker, hoogleraar chirurgie, Universitair Medisch Centrum Groningen, Groningen
Dr. C. Rosman, chirurg, Canisius-Wilhelmina ziekenhuis, Nijmegen
Dr. T. Rozema, radiotherapeut, Verbeeten Instituut, Tilburg
Prof. dr. P.D. Siersema, hoogleraar Maag-darm-leverziekten, Universitair Medisch Centrum, Utrecht
Dr. G. Tetteroo, chirurg, IJsselland ziekenhuis, Capelle a/d ijssel
Ing. P.M.J.F. Veldhuis,IKNL (Integraal Kankercentrum Nederland), Enschede/Groningen, projectmanager Managed Clinical Networks
Redactie DLSA
Drs. M. ten Berge, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Drs. R.A.M. Damhuis, arts-epidemioloog,IKNL (Integraal Kankercentrum Nederland), Rotterdam
Dr. J.P. Eerenberg, chirurg, Tergooiziekenhuizen, Hilversum
Dr. P.J. Huijstee, chirurg, Haga ziekenhuis, Den Haag
Mw. dr. W.H. Schreurs, chirurg, Medisch Centrum Alkmaar, Alkmaar
Dr. E.J. Veen, chirurg, Amphia ziekenhuis, Breda
Dr. P.H.J. M. Veldman, chirurg, ziekenhuis De Tjongerschans, Heerenveen
Dr. M.W.J.M. Wouters, chirurg, Nederlands Kanker Instituut- Antoni van Leeuwenhoek ziekenhuis, Amsterdam; hoofd wetenschappelijk bureau Dutch Institute for Clinical Auditing, Leiden
Dr. A.P.W.M. Maat, thoraxchirurg, Erasmus MC, Rotterdam
Wetenschappelijke commissie DLSA
Drs. R.A.M. Damhuis, arts-epidemioloog, IKNL (Integraal Kankercentrum Nederland), Rotterdam
Dr. J.P. Eerenberg, chirurg, Tergooiziekenhuizen, Hilversum
Dr. P.J. Huijstee, chirurg, Haga ziekenhuis, Den Haag
Mw. dr. W.H. Schreurs, chirurg, Medisch Centrum Alkmaar, Alkmaar
Dr. E.J. Veen, chirurg, Amphia ziekenhuis, Breda
Dr. P.H.J. M. Veldman, chirurg, ziekenhuis De Tjongerschans, Heerenveen
Dr. M.W.J.M. Wouters, chirurg, Nederlands Kanker Instituut- Antoni van Leeuwenhoek ziekenhuis, Amsterdam; hoofd wetenschappelijk bureau Dutch Institute for Clinical Auditing, Leiden
Redactie EPSA
Prof. dr. L.W.E. van Heurn, kinderchirurg, Maastricht Universitair Medisch Centrum, Maastricht
Wetenschappelijke commissie EPSA
Prof. dr. L.W.E. van Heurn, kinderchirurg, Maastricht Universitair Medisch Centrum, Maastricht
Dr. J.B.F. Hulscher, kinderchirurg,Universitair Medisch Centrum Groningen, Groningen
Prof. dr. R.M.H. Wijnen, hoogleraar Kinderchirurgie, Erasmus Medisch Centrum, Rotterdam
Prof. dr. D.C. van der Zee, hoogleraar Kinderchirurgie, Universitair Medisch Centrum Utrecht, Utrecht
Redactie DLRA
Mw. dr. J.S.A. Belderbos, radiotherapeut, Nederlands Kanker Instituut - Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, tevens voorzitterLandelijk Platform Radiotherapie bij Longtumoren
Dr. J. Bussink, radiotherapeut, Universitair Medisch Centrum St Radboud, Nijmegen
Dr. ir. A.L.A.J. Dekker, medisch fysicus, Maastro Clinic, Maastricht
Mw. M.M.J. PloegmakersMSc, adviseur kwaliteit vanuit orde van Medisch specialisten
Prof. dr. M. Verheij, hoogleraar Radiotherapie,Nederlands Kanker Instituut - Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, tevens voorzitter Nederlandse Vereniging voor Radiotherapie en Oncologie
Mw. dr. L.C.G. Verhoef, radiotherapeut, Universitair Medisch Centrum St. Radboud, Nijmegen, tevens bestuurslid Nederlandse Vereniging voor Radiotherapie en Oncologie
Wetenschappelijke commissie DLRA
Mw. dr. J.S.A. Belderbos, radiotherapeut, Nederlands Kanker Instituut - Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, tevens voorzitterLandelijk Platform Radiotherapie en longcarcinoom
Dr. J. Bussink, radiotherapeut, Universitair Medisch Centrum St Radboud, Nijmegen
Dr. ir. A.L.A.J. Dekker, medisch fysicus, Maastricht Universitair Medisch Centrum, Maastricht
Drs. D. Henneman, arts-onderzoeker, Dutch Institute for Clinical Auditing, Leiden
Mw. dr. K.E.A. de Jaeger, radiotherapeut, Catharina Ziekenhuis Eindhoven, Eindhoven
Mw. M.M.J. PloegmakersMSc, adviseur kwaliteit vanuit orde van Medisch specialisten
Drs. B.J.T. Reymen, radiotherapeut-oncoloog, Maastro Clinic, Maastricht
Mw. drs. E. Schaake, AIOS en onderzoeker radiotherapie, Nederlands Kanker Instituut - Antoni van Leeuwenhoek Ziekenhuis, Amsterdam
Mw. drs. C Tissing-Tan, radiotherapeut-oncoloog, Arnhems Radiotherapeutisch Instituut, Arnhem
Mw. dr. L.C.G. Verhoef, radiotherapeut, Universitair Medisch Centrum St. Radboud, Nijmegen, tevens bestuurslid Nederlandse Vereniging voor Radiotherapie en Oncologie
Redactie DSAA
Dr. B.H.P. Elsman, vaatchirurg, Deventer Ziekenhuis, Deventer
Wetenschappelijke commissie DSAA
Dr. B.H.P. Elsman, vaatchirurg, Deventer Ziekenhuis, Deventer
Dr. R.H. Geelkerken, vaatchirurg, Medisch Spectrum Twente, Enschede
Prof. dr. J.F. Hamming, hoogleraar Vaatchirurgie, Leids Universitair Medisch Centrum, Leiden
Prof. dr. D.A. Legemate, hoogleraar Vaatchirurgie, Academisch Medisch Centrum, Amsterdam
Mw. drs. E.D. Wilschut, chirurg in opleiding, Leids Universitair Medisch Centrum, Leiden
Redactie DMTR
Prof. dr. ir. J.J.M. van der Hoeven, hoogleraar Medische Oncologie,Leids Universitair Medisch Centrum, Leiden
Dr. M.W.J.M. Wouters, chirurg, Nederlands Kanker Instituut- Antoni van Leeuwenhoek ziekenhuis, Amsterdam; hoofd wetenschappelijk bureau Dutch Institute for Clinical Auditing, Leiden
Wetenschappelijke commissie DMTR
Dr. A.J.M. van de Eertwegh, oncoloog, Vrije Universiteit Medisch Centrum, Amsterdam
Prof. dr. A.J. Gelderblom, hoogleraar Medische Oncologie, Leids Universitair Medisch Centrum, Leiden
Prof. dr. J.B.A.G. Haanen, hoogleraar Medische Oncologie, Nederlands Kanker Instituut- Antoni van Leeuwenhoek ziekenhuis, Amsterdam
Prof. dr. ir. J.J.M. van der Hoeven, hoogleraar Medische Oncologie,Leids Universitair Medisch Centrum, Leiden
Dr. M.W.J.M. Wouters, chirurg, Nederlands Kanker Instituut- Antoni van Leeuwenhoek ziekenhuis, Amsterdam; hoofd wetenschappelijk bureau Dutch Institute for Clinical Auditing, Leiden
Redactie DPCA
Dr. M.G.H. Besselink, chirurg, Academisch Medisch Centrum, Amsterdam
Prof. dr. O.R.C. Busch, hoogleraar Gastro-intestinale Chirurgie, Academisch Medisch Centrum, Amsterdam
Dr. B. Groot Koerkamp, chirurg - epidemioloog, Academisch Medisch Centrum, Amsterdam
Wetenschappelijke commissie DPCA
Dr. M.G.H. Besselink, chirurg, Academisch Medisch Centrum, Amsterdam
Prof. dr. O.R.C. Busch, hoogleraar Gastro-intestinale Chirurgie, Academisch Medisch Centrum, Amsterdam
Dr. B. Groot Koerkamp, chirurg - epidemioloog, Academisch Medisch Centrum, Amsterdam
Methodologische Raad van Toezicht
Prof. dr. R. Brand, hoogleraar Good Research Data Management, Leids Universiteit Medisch Centrum, Leiden
Prof. dr. J. Kievit, hoogleraar Medische Besliskunde, Leids Universitair Medisch Centrum, Leiden
Dr. V.E.P.P. Lemmens, epidemioloog, IKZ (Integraal Kankercentrum Zuid), Eindhoven
Mw. dr. L. den Ouden, inspecteur, Inspectie voor de Gezondheidzorg
Prof. dr. E.W. Steyerberg, hoogleraar Medische Besliskunde, Erasmus Medisch Centrum, Rotterdam
Mw. prof. dr. C.A. Uyl - de Groot, hoogleraar Health Technology Assessment,Erasmus Medisch Centrum, Rotterdam
Dr. E.W. van Zwet, medisch statisticus, Leids Universitair Medisch Centrum, Leiden
Integrale Kankercentra
Mw. ir. H. Branderhorst, directeur registratie en onderzoek, IKNL (Integraal Kankercentrum Nederland)
Drs. R.A.M. Damhuis, arts-epidemioloog,IKNL (Integraal Kankercentrum Nederland), Rotterdam
Mw. dr. M.A Elferink, onderzoeker, IKNL (Integraal Kankercentrum Nederland), Enschede
Mw. dr. M.L.E.A. Jansen – Landheer, directeur netwerken, IKNL (Integraal Kankercentrum Nederland)
Mw. dr. M. van der Heiden-van der Loo, epidemioloog, IKNL (Integraal Kankercentrum Nederland)
Dr. V.E.P.P. Lemmens, epidemioloog, Hoofd Sector Onderzoek, IKZ (Integraal Kankercentrum Zuid)
Mw. dr. S. Siesling, epidemioloog,IKNL (Integraal Kankercentrum Nederland)
Ing. P.M.J.F. Veldhuis, adviseur netwerken,IKNL (Integraal Kankercentrum Nederland)

Grafisch ontwerp: Janneke Hendriks
Realisatie online-rapportage: MRDM
Drukwerk: Ando BV
Fotografie: Arend-Jan Meijer (interviews) en beeldbank DICA
Interviews: Copyrijt, Mérie van der Rijt
Coördinatie: CommunicatieLab, Linda Verkerk